Front. Immunol., 28 October 2020 | https://doi.org/10.3389/fimmu.2020.574029
La lunga storia della vitamina C: Dalla prevenzione del raffreddore comune al potenziale aiuto nel trattamento del COVID-19
Giuseppe Cerullo 1†, Massimo Negro 2*†, Mauro Parimbelli 2, Michela Pecoraro 3, Simone Perna 4, Giorgio Liguori 1, Mariangela Rondanelli 5,6, Hellas Cena 6,7 e Giuseppe D'Antona 2,6
1 Dipartimento di Scienze del Movimento e del Benessere, Università di Napoli Partenope, Napoli, Italia
2 Centro di Ricerca Interdipartimentale nelle Attività Motorie e Sportive (CRIAMS) - Centro di Medicina dello Sport, Università di Pavia, Voghera, Italia
3 Dipartimento di Farmacia, Università di Salerno, Fisciano, Italia
4 Dipartimento di Biologia, College of Science, Università del Bahrain, Sakhir, Bahrain
5 IRCCS Fondazione Mondino, Pavia, Italia
6 Dipartimento di Sanità Pubblica, Medicina Sperimentale e Forense, Università di Pavia, Pavia, Italia
7 Servizio di Nutrizione e Dietetica Clinica, Unità di Medicina Interna e Endocrinologia, ICS Maugeri IRCCS, Università di Pavia, Pavia, Italia
FONTE: https://www.frontiersin.org/articles/10.3389/fimmu.2020.574029/full
Dalle teorie di Pauling ad oggi, è stata acquisita una notevole comprensione sia del ruolo fisiologico della vitamina C che dell'impatto dell'integrazione di vitamina C sulla salute. Anche se è noto che una dieta equilibrata che soddisfi l'assunzione giornaliera di vitamina C influisce positivamente sul sistema immunitario e riduce la suscettibilità alle infezioni, i dati disponibili non supportano la teoria che gli integratori di vitamina C per via orale aumentino l'immunità. Nessuna raccomandazione clinica attuale sostiene la possibilità di ridurre significativamente il rischio di infezioni respiratorie utilizzando integratori ad alto dosaggio di vitamina C in una popolazione generale ben nutrita. Solo in sottogruppi ristretti (ad es. atleti o militari) e in soggetti con una bassa concentrazione plasmatica di vitamina C può essere giustificata un'integrazione. Inoltre, nelle categorie ad alto rischio di infezione (ad es. obesi, diabetici, anziani, ecc.), un'integrazione di vitamina C può modulare l'infiammazione, con potenziali effetti positivi sulla risposta immunitaria alle infezioni. L'impatto di un'assunzione extra orale di vitamina C sulla durata di un raffreddore e la prevenzione o il trattamento della polmonite è ancora messo in discussione, mentre, sulla base di studi di malattie critiche, l'infusione di vitamina C è stata recentemente ipotizzata come trattamento per i pazienti ospedalizzati con COVID-19. In questa revisione, ci siamo concentrati sugli effetti della vitamina C sulla funzione immunitaria, riassumendo gli studi più rilevanti, dalla prevenzione e il trattamento delle comuni malattie respiratorie all'uso della vitamina C in condizioni di malattia critica, con l'obiettivo di chiarire la sua potenziale applicazione durante un'infezione acuta da SARS-CoV2.
Introduzione
La vitamina C (acido ascorbico) svolge un ruolo importante nel normale funzionamento del sistema immunitario (1-4) e il suo utilizzo nella prevenzione e/o nel trattamento delle infezioni ha fortemente attirato l'interesse di medici e ricercatori per quasi un secolo. Una pletora di articoli sono stati pubblicati su questo argomento, ma, anche se è ben noto che una carenza di vitamina C a causa di un basso apporto nutrizionale porta ad una maggiore suscettibilità alle infezioni (5), la possibilità di ridurre l'incidenza di malattie virali in una popolazione ben nutrita attraverso l'uso di integratori alimentari a base di vitamina C non è adeguatamente supportata in letteratura. Attualmente, pochissime evidenze supportano il beneficio di alte dosi di supplementi di vitamina C sulla funzione immunitaria in individui sani (4, 6) e diversi autori hanno sottolineato che questa pratica è inefficace nel prevenire il comune raffreddore e le infezioni virali nella maggior parte dei soggetti (7-12). Nonostante ciò, la credenza popolare che un'assunzione extra di vitamina C possa potenziare il sistema immunitario è ancora diffusa e ogni anno il mercato sostiene che l'uso di integratori è un rimedio invernale per prevenire le malattie infettive.
Mentre la posizione attuale degli scienziati non è quella di raccomandare l'uso di integratori di vitamina C per prevenire invasioni virali in soggetti sani, dati più promettenti - anche se messi in discussione - sembrano invece emergere dalla somministrazione endovenosa (IA) di questa vitamina in condizioni respiratorie acute o malattie critiche. Inoltre, è stato recentemente proposto un potenziale ruolo farmacologico durante le prime fasi dell'infezione da nuovo coronavirus (SARS-CoV2) e della sua malattia correlata (COVID-19) (13-18).
La rapida diffusione mondiale della SARS-CoV2 e la conseguente emergenza pandemica riconosciuta dall'Organizzazione Mondiale della Sanità richiede uno sforzo globale per identificare tutto ciò che può curare i sintomi e ridurre i decessi. All'inizio di giugno erano stati segnalati a livello globale oltre 6.600.000 casi di infezione e 391.000 decessi legati alla COVID-19 e il numero di casi è in costante aumento in tutto il mondo (19). Attualmente, non è stata approvata alcuna terapia antivirale specifica per la cura di COVID-19 (20), e questo ha portato i ricercatori a speculare su un possibile trattamento adiuvante basato su prove indirette di pazienti gravemente malati e pazienti con condizioni di sepsi (21). La sepsi è una disfunzione d'organo pericolosa per la vita, causata da una ridotta risposta dell'ospite all'infezione, caratterizzata da un drammatico cedimento del sistema circolatorio, metabolico e immunitario, e riconosciuta come la causa primaria di morte per infezione: i pazienti che sviluppano uno shock settico possono avere tassi di mortalità ospedaliera fino al 50% (22). Su queste condizioni cliniche la letteratura dimostra che alte dosi di vitamina C per infusione endovenosa possono ridurre la produzione infiammatoria legata alle citochine e potenzialmente migliorare risultati importanti come la durata del tempo di ventilazione meccanica e i tassi di mortalità (13-18). Ciò è di particolare importanza in quanto la sindrome da distress respiratorio acuto (ARDS) è una delle condizioni gravi più frequenti registrate nei pazienti COVID-19 (23). L'ARDS è una sindrome grave e, in alcuni casi, mortale, caratterizzata da una forte risposta infiammatoria con danni alveolari massicci e insufficienza multipla degli organi, che richiede un trattamento in terapia intensiva (24). Gli autori hanno riportato una percentuale di casi di ARDS di circa il 15% tra i pazienti ospedalizzati con infezione da SARS-CoV2 (25).
I dati sull'uso della vitamina C somministrata per via endovenosa nei pazienti con COVID-19 non sono ancora disponibili, ma gli studi clinici per esplorare l'efficacia di questo trattamento sono attualmente in corso in diversi paesi (26) e risultati importanti saranno presto disponibili.
Sulla base di quanto sopra, lo scopo di questa revisione è innanzitutto quello di riassumere il ruolo immunologico della vitamina C con una descrizione dei suoi potenziali effetti come integratore alimentare, sui meccanismi coinvolti durante le infezioni virali respiratorie e in relazione alla risposta infiammatoria considerando diverse categorie di soggetti e condizioni cliniche; in secondo luogo, il manoscritto descrive la letteratura aggiornata sulla IA della vitamina C nel trattamento di gravi condizioni di sepsi e ARDS, con l'obiettivo di stabilire se l'attuale background clinico su questo argomento offre prospettive abbastanza forti da proporre la vitamina C per un'applicazione farmacologica che riduca la drammatica produzione di citochine e regoli altre risposte immunitarie riconosciute legate al COVID-19.
Fisiologia della vitamina C
Biodisponibilità
La vitamina C è un nutriente essenziale che deve essere assunto attraverso la dieta in quanto l'uomo non è in grado di sintetizzarlo (27). Così, il nostro corpo ha sviluppato un efficace sistema di adattamento che mantiene le riserve organiche di vitamina C e previene la sua carenza a causa di un basso apporto dietetico. Questi adattamenti includono una maggiore capacità di assorbimento e di riciclaggio della vitamina C rispetto ad altre specie animali (ad esempio, capre e rettili), che normalmente possono produrla (28, 29). Studi su animali hanno dimostrato che la vitamina C è preferibilmente immagazzinata nel cervello, nella ghiandola surrenale, nel fegato e nei polmoni (30-33), ma i suoi livelli in questi organi si esauriscono rapidamente dopo circa una settimana di insufficienza alimentare (31). Nell'uomo, il muscolo scheletrico rappresenta il principale pool di vitamina C (34). Le fibre muscolari perdono anche il contenuto di vitamina C molto rapidamente sotto l'inadeguato apporto dietetico. Tuttavia, un consumo di mezzo kiwi al giorno sembra essere sufficiente a saturare le concentrazioni di vitamina C del tessuto muscolare negli uomini non fumatori (35). L'omeostasi della vitamina C è finemente regolata da almeno quattro meccanismi: assorbimento intestinale, trasporto ai tessuti, ricaptazione renale ed escrezione delle urine, regolata principalmente da una famiglia di proteine chiamate Sodium-Dependent Vitamin C Transporters (SVCT) (36). Considerando la variabilità individuale nei soggetti sani, gli studi suggeriscono che un apporto giornaliero di vitamina C da 100 a 400 mg garantisce il 100% della biodisponibilità e della saturazione del sangue con uno stato costante di concentrazione plasmatica che raggiunge un livello massimo di circa 70-80 µmol/L (37, 38). Generalmente, se l'assunzione di vitamina C supera i 500 mg/giorno, viene inibito un ulteriore aumento della concentrazione plasmatica e la biodisponibilità può diminuire di quasi il 30% quando vengono somministrati più di 1.000 mg di vitamina C in un singolo incontro (39). Questo avviene perché quando vengono somministrati 500-1.000 mg di vitamina C per via orale, il trasportatore intestinale (SVCT1) raggiunge rapidamente la sua massima saturazione, mentre l'escrezione di urina della vitamina viene progressivamente aumentata (38, 39).Si può prendere in considerazione la misura della concentrazione di vitamina C nel plasma, anche se i valori del circolante non possono essere usati come un indicatore affidabile dei depositi del corpo (circa 5 g) (40). Un valore di concentrazione plasmatica della vitamina C inferiore a 23 μmol/L riflette un esaurimento del pool di vitamina C (stato di ipovitaminosi), mentre i sintomi clinici dello scorbuto si verificano quando i valori plasmatici sono inferiori a 11 μmol/L (41).
Integrazioni dietetiche raccomandate
Per mantenere un'adeguata conservazione del corpo, nel corso degli anni è stata proposta un'indennità dietetica raccomandata (RDA) per la vitamina C. Le RDA variano da Paese a Paese: ad esempio, le attuali raccomandazioni negli Stati Uniti e in Canada sono di 90 mg/giorno per gli uomini adulti e di 75 mg/giorno per le donne adulte (42), mentre in Italia le assunzioni consigliate sono rispettivamente di 105 mg/giorno e 85 mg/giorno per uomini e donne adulti (43). Questa variazione delle RDA può essere spiegata dai diversi criteri utilizzati da varie autorità per definire il fabbisogno medio stimato (EAR) di vitamina C, tra cui la prevenzione dello scorbuto, il sostegno delle cellule immunitarie, il mantenimento di un adeguato livello di vitamina C nel plasma e l'ottimizzazione della salute (44). Inoltre, le RDA variano da soggetto a soggetto in quanto diversi fattori possono modificare il fabbisogno di vitamina C, tra cui il sesso, l'età, il fumo, la gravidanza e l'allattamento (44).
Diversi autori e linee guida hanno indicato che i maschi hanno bisogno di più vitamina C rispetto alle femmine (45-51) probabilmente a causa del peso corporeo più elevato e della massa senza grassi degli uomini rispetto alle donne (52).
Nei bambini e negli adolescenti le RDA per la vitamina C sono generalmente derivate dai bisogni degli adulti e regolate in relazione alla loro minore massa corporea (46, 47, 53), come riportato da Carr e Lykkesfeldt (44). In Italia, ad esempio, il SINU raccomanda un apporto di 45 mg per i bambini dai 4 ai 6 anni (45). Gli studi epidemiologici indicano che negli anziani è possibile riscontrare uno stato di vitamina C inferiore, suggerendo che essi richiedono un apporto maggiore rispetto agli adulti (54-56). Tuttavia, attualmente solo la Francia ha sviluppato linee guida specifiche per i soggetti a partire dai 75 anni di età, indicando un'assunzione giornaliera di 120 mg (57).
Il fabbisogno di vitamina C è più elevato nelle donne durante la gravidanza (44): l'emodiluizione dovuta all'aumento del volume del sangue e l'assorbimento attivo della vitamina C da parte del feto durante il suo sviluppo portano ad una riduzione dello stato vitaminico (58). Anche l'allattamento aumenta il fabbisogno di vitamina C delle donne, per soddisfare il fabbisogno di vitamine del neonato in crescita normale. La maggior parte dei paesi raccomanda una dose giornaliera supplementare di 10-20 mg per le donne in gravidanza e una dose giornaliera supplementare di 20-60 mg/giorno per le donne durante l'allattamento (44).
I fumatori hanno di solito valori plasmatici inferiori rispetto ai non fumatori, probabilmente a causa dell'aumento dello stress ossidativo e del maggiore turnover di vitamina C. Oltre a ciò, una riduzione dello stato di vitamina C nei fumatori è anche dovuta all'assunzione di vitamina C con la dieta, che è di solito inferiore rispetto ai non fumatori (59). Pertanto, per compensare queste condizioni, le autorità hanno raccomandato un'assunzione supplementare di 20 - 80 mg/giorno di vitamina C per questi soggetti, fissando le RDA per i fumatori a 120-155 mg/giorno (44).
Alcuni altri fattori sono stati riconosciuti come fattori che riducono lo stato di vitamina C (60), anche se non sono stati considerati nelle linee guida generali e i valori aggiuntivi giornalieri di vitamina C potenzialmente necessari non sono attualmente disponibili. Questi fattori includono: 1) l'esposizione passiva al fumo di tabacco e agli inquinanti ambientali, che possono aumentare lo stress ossidativo; 2) l'influenza geografica, lo status socioeconomico e culturale, che può avere un impatto sulla produzione, la selezione e il consumo di alimenti tipicamente ricchi di vitamina C; 3) i metodi di preparazione e cottura dei cibi, che possono ridurre il contenuto di vitamina C negli alimenti, poiché questa vitamina è solubile in acqua e termolabile.
La potenziale variabilità del metabolismo della vitamina C tra i vari gruppi etnici è praticamente sconosciuta e questo argomento dovrebbe certamente essere ulteriormente approfondito. Solo uno studio ha riportato che concentrazioni più basse di vitamina C sono state associate in modo significativo ad un maggior numero di leucociti negli afroamericani ma non nei caucasici, suggerendo ipotetiche differenze metaboliche o farmacocinetiche tra le razze (61).
Vitamina C e regolazione del sistema immunitario
Oltre a una vasta gamma di percorsi biochimici in cui la vitamina C è coinvolta, partecipa anche alla risposta del sistema immunitario innato e adattivo (1). Il contenuto intracellulare di vitamina C nelle cellule immunitarie dipende dalla disponibilità di plasma. Negli adulti sani il contenuto di vitamina C nei leucociti può essere saturato con un apporto di almeno 100 mg di vitamina C al giorno, attraverso gli alimenti, ottenendo una concentrazione di circa 3,5, 3 e 1,5 mmol/L, rispettivamente, in linfociti, monociti e neutrofili (39, 62-65). L'assorbimento dei leucociti di vitamina C dal sangue è molto efficiente, attraverso le proteine SVCT (66), ottenendo un contenuto intracellulare da 50 a 100 volte superiore alla concentrazione plasmatica (67, 68). Come efficace antiossidante, la vitamina C contribuisce a proteggere i neutrofili dallo stress ossidativo durante le prime fasi di una risposta immunitaria, quando i neutrofili attivano la fagocitosi e producono specie reattive dell'ossigeno (ROS) per distruggere gli antigeni (69, 70). Una volta esaurita la capacità fagocitaria e i neutrofili iniziano a morire, la vitamina C sembra regolare il processo a favore dell'apoptosi, attraverso l'attivazione di una cascata caspasica dipendente, inibendo il passaggio alla necrosi, e determinando una più efficiente risoluzione dell'infiammazione (71).
La vitamina C è anche coinvolta nella migrazione dei fagociti (neutrofili e macrofagi) verso i siti di infezione in risposta ai chemioattrattori (72, 73). Ciò è particolarmente importante poiché una chemiotassi neutrofila compromessa è stata osservata in pazienti con infezione grave (74-76). Inoltre, nei soggetti con basse concentrazioni di vitamina C nel sangue (<50 µmol/L), un'assunzione giornaliera di 250 mg di vitamina C può comportare un aumento del 20% della capacità di migrazione dei neutrofili (6). Al contrario, nei soggetti con una concentrazione fisiologica di vitamina C nel sangue, la mobilità dei neutrofili non può essere aumentata, come dimostrato da Bozonet et al. (4), in cui i neutrofili isolati da volontari sani e incubati con una soluzione di vitamina C (200 µmol/L) per aumentare artificialmente il loro contenuto di ascorbato non hanno mostrato una grande capacità chemiotattica.
Analogamente ai neutrofili, la vitamina C protegge i linfociti dai danni ossidativi (77) e ha un ruolo fondamentale nello sviluppo e nella funzione di queste cellule, anche se i meccanismi esatti non sono ancora stati chiariti (3). Nei linfociti T, la vitamina C stimola la differenziazione e la proliferazione dai precursori alle cellule T mature, in modo dose-dipendente (78). Gli studi sull'influenza della vitamina C sui sottotipi di cellule T sono principalmente legati all'equilibrio Th1/Th2. I rapporti sottolineano che la vitamina C può indurre uno spostamento delle risposte immunitarie da Th2 a Th1 (3), mentre solo uno studio suggerisce che la vitamina C può indurre la polarizzazione Th17 delle cellule CD4+ ingenue nel modello murino, influenzando il meccanismo epigenetico (79). Al momento, non sono disponibili studi che esplorino gli effetti della vitamina C sulle cellule T citotossiche (3). Nei linfociti B, la vitamina C sembra influenzare la produzione di anticorpi, nonostante le prove contrastanti (80-87). I livelli fisiologici di vitamina C sono anche necessari per il normale sviluppo e la funzione delle cellule normali del killer naturale (NK) (3). Nei topi con deficit di vitamina C, l'attività citotossica NK (NKCA) era inferiore a quella dei topi con livelli normali di vitamina C (88), mentre i livelli soprafisiologici di ascorbato non aumentano ulteriormente NKCA (89).
La vitamina C regola anche la risposta infiammatoria. Negli studi su animali, la carenza di vitamina C è stata collegata con livelli più alti di istamina in circolazione, che può essere riequilibrato una volta che il livello di vitamina C nel sangue è stato normalizzato (90-92). Inoltre, la vitamina C può ridurre la produzione di citochine pro-infiammatorie derivate dai leucociti (ad esempio, TNFα e IL-6), attraverso la modulazione del fattore di trascrizione nucleare kappa B (NFkB) (2, 93, 94) in almeno due modi: 1) attraverso la sua forma ridotta (ascorbato), da scavenging ROS cellulare ROS e inibendo la segnalazione ROS-correlata per la trascrizione di NFkB (95-98); 2) attraverso la sua forma ossidata (deidroascorbato), prodotto come conseguenza di estinzione ROS, inibendo direttamente l'attività di diverse chinasi coinvolte nella TNFα-mediata attivazione di NFkB (p38 mitogen-attivato proteina chinasi, IkB chinasi α e β) (99-101).
Tuttavia, l'effetto della vitamina C sull'equilibrio delle risposte delle citochine (pro e antinfiammatorie) è molto complesso e sembra dipendere dal tipo di cellula e / o condizione infiammatoria (1). Inoltre, gli autori (102, 103) hanno recentemente suggerito che la vitamina C può interagire con le vie molecolari legate allo stress infiammatorio e alle disfunzioni immunitarie durante la sepsi, coinvolgendo particolari mediatori: Recettore del fattore di crescita epidermico (EGFR), Proteina Kinase-1 attivata da Mitogen (MAPK1), Proto-Oncogene c (JUN), C-C chemochine recettore tipo 5 (CCR5), Proteina Kinasi 3 attivata da Mitogen (MAPK3), Angiotensina II recettore tipo 2 (AGTR2), e Trasduttore di segnale e attivatore di trascrizione-3 (STAT3).
Gli effetti della vitamina C sulla funzione immunitaria possono anche essere espressi attraverso regolamenti epigenetici, anche se questo argomento è ancora poco compreso (104, 105). Il rimodellamento epigenetico associato all'attivazione e alla differenziazione delle cellule immunitarie comprende la modificazione del DNA e dell'istone (106). La vitamina C svolge un ruolo importante aumentando l'attività degli enzimi epigenetici, tra cui le proteine di traslocazione dieci e undici (TET) e le demetilasi degli istoni (JHDM) contenenti il dominio Jumonij-C (107). Infatti, poiché TET e JHDMs appartengono alla superfamiglia delle diossigenasi Fe2+/α-ketoglutaratodipendenti (105), la vitamina C, come ascorbato, essendo in grado di donare elettroni, agisce come cofattore per questi enzimi, riducendo il Fe3+ alla sua forma cataliticamente attiva (Fe2+) (63). Le proteine TET sono coinvolte nella demetilazione dei residui di citosina nel DNA, mentre i JHDM regolano la metilazione dei residui di lisina e arginina negli istoni, con conseguenti modifiche della trascrizione genica (63, 108, 109) che sono coinvolte nella risposta sia del sistema immunitario innato che di quello adattivo (106, 110). L'utilità di queste funzioni di regolazione genica recentemente scoperte di vitamina C per la valutazione delle raccomandazioni dietetiche non è stata ancora chiarita e sono necessarie ulteriori ricerche per indicare la dose minima alla quale la vitamina C può avere un impatto efficace sui risultati funzionali o clinici attraverso cambiamenti epigenetici (44).
Integratore orale di vitamina C per la prevenzione e il trattamento delle infezioni comuni del raffreddore e delle vie respiratorie superiori
Il comune raffreddore è una delle più diffuse infezioni virali delle alte vie respiratorie (URTI), caratterizzata da tosse, stanchezza, febbre, mal di gola e dolori muscolari, che persistono per un periodo che va da pochi giorni a non più di 3 settimane (111, 112). Il termine "raffreddore comune" si riferisce ad una sindrome aspecifica causata da diversi virus, anche se il rinovirus è l'agente patogeno più frequentemente coinvolto, essendo presente nel 30-50% dei pazienti (113). Nonostante la sintomatologia sia solitamente molto lieve, il raffreddore comune è una delle principali cause di assenteismo dal lavoro e dalla scuola (114). Il mito popolare secondo cui un'assunzione molto elevata di vitamina C può portare a una minore suscettibilità alle infezioni delle vie respiratorie deriva dalle teorie di Linus Pauling pubblicate negli anni Settanta. Secondo Pauling, un apporto giornaliero di vitamina C di 1.000 mg può ridurre l'incidenza dei raffreddori di circa il 45% e l'apporto giornaliero ottimale di vitamina C per vivere in salute e prevenire le malattie dovrebbe essere di almeno 2,3 g (115, 116). La risposta del mercato statunitense a questo punto di vista pionieristico è stata immediata e le vendite di integratori alimentari di vitamina C sono quasi raddoppiate in un paio d'anni (117). Tuttavia, altri studi clinici con scopi simili non sono riusciti a dimostrarne l'efficacia (118-121) e, in generale, gli autori contemporanei hanno completamente confutato le idee di Pauling, basate principalmente su studi controllati non randomizzati o su un'applicazione non corretta del background animale all'uomo (122, 123). Anche se un'elevata dose giornaliera di vitamina C non sembra prevenire le infezioni virali nella popolazione generale, alcune categorie di soggetti con un rischio potenzialmente più elevato di infezione virale possono richiedere una particolare considerazione. Tra questi soggetti vi sono individui sottoposti a un pesante carico di lavoro fisico giornaliero, come soldati e atleti, che possono sviluppare una condizione di stress immunitario.
Popolazione generale
Se si escludono alcuni risultati che riportavano solo piccoli o incoerenti effetti attribuibili alla vitamina C (124), dopo decenni di indagini, la comunità scientifica ha stabilito che un elevato apporto di vitamina C è inutile per prevenire il comune raffreddore (7-11), e quindi una regolare integrazione giornaliera non è giustificata nella popolazione generale (12). La recente meta-analisi ha raggiunto conclusioni simili per quanto riguarda l'incidenza dell'infezione, sottolineando, tuttavia, la possibilità di ridurre la durata di un raffreddore. Gómez et al. (125), hanno dimostrato che 8.472 soggetti di otto studi clinici randomizzati (RCT), hanno mostrato una forte evidenza che l'assunzione di vitamina C superiore a 80 mg/giorno non impedisce il comune raffreddore in adulti e bambini sani. Vorilhon et al. (126), hanno analizzato otto RCT e hanno confermato che l'integrazione di vitamina C (dosaggio da 0,5 g a 2 g/giorno) non è efficace, rispetto al placebo, nel ridurre l'incidenza delle infezioni delle vie respiratorie superiori (URTI) in 3.135 bambini (da 3 mesi a 18 anni), anche se la somministrazione può ridurre la durata delle URTI del 14%, come precedentemente evidenziato da Rondanelli et al. (127). Risultati positivi sulla durata dei raffreddori sono stati suggeriti anche dalla meta-analisi di Ran et al. (128) in cui la combinazione di una piccola dose giornaliera a lungo termine di vitamina C (non più di 1 g/giorno) per sostenere l'immunità e una dose maggiore di vitamina C durante l'insorgenza del comune raffreddore (di solito 3-4 g/giorno) è stata associata alla capacità di alleviare il dolore al petto, la febbre e i brividi, riducendo la durata della permanenza in casa, così come la durata media della malattia.
Persone sotto forte stress fisico
Alcuni autori hanno riportato un'alta incidenza di infezioni respiratorie nei centri di addestramento militare, probabilmente anche a causa di un sovraffollamento di individui spesso provenienti da diverse aree geografiche (129-131). Sono disponibili ulteriori dati sugli atleti, per i quali gli allenamenti e le competizioni giornaliere ad alta intensità sono stati associati a perturbazioni immunitarie transitorie, condizioni infiammatorie e maggiore suscettibilità alle infezioni (132-134). Inoltre, rispetto alla popolazione generale, gli atleti hanno una maggiore esposizione agli agenti patogeni, a causa dei frequenti viaggi e degli eventi sportivi (135, 136), che possono potenzialmente aumentare il rischio di sviluppare infezioni virali.
I dati della letteratura che si riferiscono all'effetto dell'integrazione di vitamina C sulla prevenzione del comune raffreddore in questi soggetti sono interessanti, nonostante siano attualmente limitati. Come è stato ben descritto da Hemilä e Chalker, (12) l'integrazione di vitamina C può diminuire l'incidenza di raffreddori di circa il 50% nelle persone sotto stress fisico estremo. Più recentemente, Kim et al. (137) hanno effettuato un grande studio randomizzato, in doppio cieco, controllato con placebo in 1.444 soldati coreani, 695 dei quali hanno ricevuto vitamina C (6 g/giorno) per 30 giorni. Hanno dimostrato che il gruppo della vitamina C aveva un rischio di prendere il comune raffreddore di 0,80 volte inferiore rispetto al gruppo del placebo (n = 749).
La base teorica per l'uso della vitamina C nei soggetti fisicamente stressati risiede nel significativo aumento della produzione di ROS dovuto all'esercizio fisico intenso (138), con notevoli danni tissutali / risposta infiammatoria che possono avere conseguenze dannose sulla prevenzione dell'URTI (139), richiedendo eventualmente un maggiore apporto di antiossidanti rispetto alla popolazione generale (140). Nonostante ciò, è stato recentemente stabilito che la somministrazione di un'alta dose di antiossidanti può interferire negativamente con la segnalazione del redox indotto dall'esercizio fisico e gli adattamenti muscolari (141-147) e l'uso di alte dosi di vitamina C per abolire il ROS, soprattutto per un lungo periodo, dovrebbe essere evitato (148, 149).
Anche se gli effetti della vitamina C isolata sullo stress ossidativo, i marcatori infiammatori, i danni muscolari e la risposta immunitaria dopo l'esercizio fisico rimangono da chiarire in profondità (146), una recente posizione della società scientifica stand (150), una recente revisione (140), e una meta-analisi (146) concordano nel raccomandare l'integrazione di vitamina C (0,25-1,0 g / giorno) come opzione per prevenire i sintomi URTI negli atleti sotto forte sforzo e / o durante i periodi di aumento del rischio di infezione (ad esempio, viaggi all'estero) (140); gli atleti con basse concentrazioni iniziali di vitamina C nel sangue sono i principali candidati all'integrazione (146, 149, 151, 152).
Integrazione orale di vitamina C per la prevenzione e il trattamento della polmonite
La polmonite è un'infezione delle vie respiratorie inferiori caratterizzata da tosse, difficoltà respiratorie, dolore toracico, febbre e infiammazione polmonare (153). La polmonite è la prima causa di morte per infezione negli Stati Uniti e la quinta causa di morte in assoluto (154, 155). Streptococcus pneumoniae e Haemophilus influenzae sono riconosciuti come i più comuni agenti responsabili della polmonite (156), ma anche altri agenti patogeni sono in grado di indurre la polmonite, compresi virus e funghi (153, 154).
I risultati ottenuti in ratti e topi hanno suggerito che la vitamina C integrata per via orale può essere utile per ridurre la suscettibilità alla polmonite virale e potenzialmente per ridurre lo sviluppo di ARDS (157, 158), che è riconosciuta come la forma più grave di infezione respiratoria acuta (159). Tuttavia, i risultati umani sull'integrazione di vitamina C e sulla polmonite rimangono scarsi, con poche osservazioni datate basate principalmente su particolari soggetti e condizioni (ad esempio, militari, paesi in via di sviluppo) e non generalizzabili (5, 160). Su questo argomento, la più recente meta-analisi, che include 2.774 partecipanti di sette studi clinici, ha sottolineato che le prove attuali sono insufficienti per sostenere l'efficacia dell'integrazione di vitamina C nella prevenzione o nel trattamento della polmonite, a causa del numero ridotto di studi e della qualità molto bassa dei risultati esistenti (161). Tuttavia, la meta-analisi di Padhani et al. (161) ha preso in considerazione studi di popolazioni diverse, inclusi tre studi sui bambini, senza analisi di sottogruppo. Poiché la farmacocinetica della vitamina C varia da sottogruppo a sottogruppo e non è ancora nota nei bambini, l'analisi dei dati avrebbe dovuto essere effettuata in modo indipendente e, pertanto, le conclusioni di questo studio possono essere discutibili.
Integratore orale di vitamina C per la prevenzione di COVID-19
COVID-19 è una nuova forma di polmonite virale riconosciuta in tutto il mondo, causata dall'infezione da SARS-CoV2 (162, 163). La sintomatologia inizia spesso entro 2 settimane dal contagio e comprende principalmente febbre, stanchezza, tosse e mancanza di respiro (164). Le conoscenze attuali suggeriscono che, mentre la maggior parte dei soggetti infetti (80%-90%) presenta sintomi lievi o può essere asintomatica, circa il 5% può sviluppare polmonite, ARDS e disfunzioni multiorgano che portano alla morte (165).
È indubbio che uno stato nutrizionale ottimale riduce efficacemente l'infiammazione e lo stress ossidativo, migliorando la regolazione del sistema immunitario (166). Tuttavia, non sono attualmente disponibili dati sull'uso regolare di alte dosi di vitamina C per via orale per ridurre il rischio di infezione da SARS-CoV2 in una popolazione generale sana (167-169) e sono necessari ulteriori studi per esplorare il ruolo della vitamina C nella prevenzione di COVID-19 (169). Per i soggetti fortemente stressati (in particolare gli atleti), non sono attualmente riportati dati specifici riguardanti l'incidenza, la prevalenza o la storia naturale della malattia relativa a COVID-19 (134), nonostante il rischio potenzialmente elevato di esposizione a questo virus per questi soggetti (136, 170). Inoltre, non sono stati espressi pareri scientifici in merito all'uso della vitamina C per via orale per prevenire l'infezione da SARS-CoV2 in soggetti che praticano un'attività fisica estrema. Tuttavia, un'integrazione di vitamina C può essere efficace per migliorare lo stato di salute dei pazienti considerati ad alto rischio di infezioni virali (171).
Integratore orale di vitamina C per i pazienti con disturbi metabolici, malattie cardiovascolari e soggetti anziani fragili: Rapporto potenziale con COVID-19
Esistono in particolare alcuni fattori che aumentano il rischio di sviluppare l'infezione da SARS-CoV2 e influiscono sulla gravità della COVID-19 (172). Le persone con malattie non trasmissibili (MNT) preesistenti sembrano essere più suscettibili di sviluppare la COVID-19 (173, 174). Le MNT comprendono l'obesità, il diabete mellito, le malattie polmonari croniche, le malattie cardiovascolari (CVD) e varie altre condizioni che sono caratterizzate da un'infiammazione sistemica che compromette la risposta immunitaria e può esacerbare la tempesta di citochine legata alla COVID-19 (173, 174).
Soggetti obesi
Alcuni studi hanno dimostrato che l'obesità è associata a una forma più grave di COVID-19 (175, 176), anche in pazienti più giovani (età < 50 anni) (177), e un IMC > 40 kg/m2 è stato identificato come uno dei più forti rischi di ospedalizzazione a causa dell'infezione da SARS-CoV2 (178). Questi risultati sono preoccupanti se si considera che l'obesità è un fenomeno globale e che in paesi come gli Stati Uniti circa il 36% della popolazione è obesa (179). Questa associazione potrebbe essere legata a meccanismi infiammatori, poiché gli autori suggeriscono che, rispetto a individui con un peso normale, i soggetti obesi hanno una maggiore concentrazione plasmatica di Proteina C reattiva (CRP), un biomarcatore infiammatorio utilizzato per prevedere le malattie cardiovascolari (180). Sulla base di ciò, un'integrazione di vitamina C in questi soggetti può essere utile per ridurre l'infiammazione, considerando i dati che hanno mostrato come un trattamento di vitamina C per via orale (1.000 mg/giorno) per due mesi può ridurre significativamente la CRP plasmatica in soggetti sani, sovrappeso, non fumatori con CRP di base ≥ 1,0 mg/L (181). Questo risultato è molto interessante, tenendo conto che i partecipanti avevano un adeguato apporto dietetico di vitamina C, con un livello plasmatico medio di base di 57,8 μmol/L, e suggerisce che le RDA per la vitamina C negli individui obesi possono essere sottovalutate, come è stato recentemente sottolineato da Rychter et al. (182, 183). La ricerca è necessaria per capire se riducendo il CRP con la vitamina C potrebbe essere possibile influenzare l'incidenza e / o la progressione delle malattie infiammatorie mediate da malattie associate all'obesità, comprese le infezioni e potenzialmente COVID-19 (171).
Soggetti diabetici
Una recente meta-analisi, che comprende 33 studi (16.003 pazienti), ha confermato che i diabetici hanno un aumento di due volte superiore della mortalità, così come la gravità del COVID-19, rispetto ai pazienti non diabetici COVID-19 (184). Il diabete mellito di tipo 2 (T2DM) è la forma più comune di diabete (185), caratterizzato da iperglicemia cronica, infiammazione e stress ossidativo (186). La condizione infiammatoria osservabile nel diabete può eventualmente essere un meccanismo che aumenta la suscettibilità al COVID-19. Basse concentrazioni plasmatiche di vitamina C nelle persone con T2DM è stato osservato (187, 188), nonostante un adeguato apporto di vitamina C (189, 190). Due meccanismi potrebbero spiegare in particolare i bassi livelli di vitamina C in questi pazienti: 1) aumento dell'escrezione urinaria, specialmente in quelli con microalbuminuria (191); 2) maggiore esaurimento della vitamina C causato da un aumento dello stress ossidativo (190, 192). Un interessante studio sull'uso della vitamina C per via orale nei soggetti diabetici è stato riportato da Mason et al. (193). Esso ha mostrato un'espressione SVCT2 potenziata di circa due volte nel muscolo scheletrico dopo l'integrazione di vitamina C (1.000 mg per 4 mesi) in persone con T2DM, con un aumento della concentrazione muscolare di vitamina C e una diminuzione dello stress ossidativo muscolare. Tuttavia, dato il numero ridotto di soggetti studiati in questo studio (sette partecipanti, sei maschi e una femmina), sono necessari studi più ampi per confermare risultati simili. I risultati di un RCT hanno mostrato che l'integrazione di vitamina C (1.000 mg/giorno per 8 settimane) ha ridotto significativamente la CRP, IL-6, il glucosio nel sangue a digiuno (FBG) e i trigliceridi (TG) in 64 pazienti obesi, ipertesi e/o diabetici, con alti livelli di CRP ≥ 6 mg/L (194). Inoltre, i dati meta-analitici indicano che l'integrazione di vitamina C per più di 30 giorni con un dosaggio che va da 200 a 1.000 mg riduce significativamente la FBG nei pazienti con T2DM (195). Sulla base di quanto sopra, l'integrazione di vitamina C può rappresentare un'opzione promettente per modulare l'infiammazione e il glucosio nel sangue nei pazienti con iperglicemia e CRP elevata, potrebbe potenzialmente essere in grado di migliorare la salute di questi individui e ridurre la suscettibilità alle infezioni. Le indagini sono fortemente incoraggiate a stabilire una possibile correlazione tra un'assunzione extra di vitamina C e una possibile diminuzione dell'incidenza, della gravità e della mortalità per COVID-19.
Soggetti con CVD
I CVD (così come l'ipertensione) sono le comorbidità più comuni tra i pazienti COVID-19 (174, 196, 197). Gli individui affetti da CVD sono cinque volte più a rischio di sviluppare lo stadio critico della malattia, come indicato in una meta-analisi che ha coinvolto oltre 3.000 pazienti affetti da COVID-19 (198). In questo caso, la ragione principale per un rischio più elevato di infezione da SARS-Cov2 è legata all'espressione dell'enzima ad alta conversione dell'angiotensina 2 (ACE2) osservata in questi pazienti (199-201), poiché questo enzima è utilizzato dal virus per invadere le cellule, favorendo la colonizzazione virale (202). È noto che basse concentrazioni plasmatiche di vitamina C sono predittive di un aumento del rischio di CVD (203-205), ma l'attuale letteratura fornisce scarso supporto per un uso diffuso di integratori di vitamina C per ridurre il rischio di CVD o la mortalità (206), e anche i dati disponibili sono controversi. Molti studi di coorte e RCT non hanno mostrato alcuna relazione tra l'assunzione di vitamina C e il rischio di CVD. Tuttavia, nella maggior parte degli RCT i partecipanti non sono stati sottoposti a prescrizione per uno stato di esaurimento e questo limita seriamente la possibilità di trarre conclusioni sui risultati, poiché l'impatto potenziale dell'integrazione di vitamina C sui risultati considerati può variare da altamente significativo a trascurabile in relazione al loro stato di vitamina C all'inizio dello studio (207).
Alcuni altri studi hanno suggerito benefici moderati e alcuni riferimenti hanno registrato un leggero aumento del rischio (206). Una barriera significativa alla comprensione della relazione tra vitamina C e CVD è la mancanza di studi meccanicistici nell'uomo (206). Attualmente, non ci sono raccomandazioni per una dose giornaliera aggiuntiva di vitamina C nei CVD per prevenire potenzialmente malattie, comprese le infezioni polmonari e COVID-19.
Soggetti anziani fragili
È particolarmente importante considerare le comunità anziane quando si cerca di prevenire COVID-19. Gli anziani sono più vulnerabili rispetto alla popolazione generale a causa di un aumento del rischio di malnutrizione e di infezioni e di un'alta prevalenza di MNT (208). L'età stessa è un fattore di rischio per lo sviluppo della COVID-19 (209), a causa di un declino funzionale del sistema immunitario (210, 211). Inoltre, la malnutrizione in questi soggetti è molto frequente per diversi motivi (ad esempio, cattive condizioni socioeconomiche, stato mentale, stato sociale) (212) e deficienze nutrizionali (compresa la vitamina C) sono stati segnalati (213). La malnutrizione può peggiorare il sistema immunitario degli anziani, rendendoli più suscettibili alle infezioni (214). Nei soggetti anziani ospedalizzati (età media 81 anni) affetti da bronchite acuta o polmonite, è stato riportato un livello medio plasmatico di vitamina C al basale di 23 µmol/L ed è stata riscontrata una concentrazione di 11 µmol/L in un terzo dei pazienti (215). Ciò è particolarmente importante in quanto una bassa concentrazione di vitamina C (<17 µmol/L) nelle persone anziane (di età compresa tra i 75 e gli 82 anni) è considerata un forte fattore predittivo di mortalità totale (216). In particolare, nello studio di Hunt (215) la somministrazione di vitamina C (0,2 g/giorno) ha ridotto il punteggio dei sintomi respiratori nei pazienti più gravi. Tuttavia, al momento, non è noto se una regolare integrazione con la vitamina C possa proteggere questi soggetti dalla cronica inflammation NCDs e/o possa prevenire l'insorgenza di infezioni virali tra cui COVID-19.
Integratore orale ed effetti collaterali
La vitamina C ha un eccellente profilo di sicurezza, soprattutto grazie alla sua elevata solubilità in acqua e alla rapida eliminazione dei livelli in eccesso da parte dei reni (44, 217). Anche se non è possibile stabilire un UL per la vitamina C, valori di 1.000-2.000 mg/giorno sono stati suggeriti come limiti prudenti da alcuni paesi, sulla base di un potenziale rischio di diarrea osmotica e di disturbi gastrointestinali correlati in alcuni individui a dosi più elevate (44, 53).
Poiché la vitamina C è parzialmente convertita in ossalato ed escreta nelle urine, alte dosi di vitamina C potrebbero essere associate alla formazione di calcoli di ossalato di calcio (218, 219). Ferraro et al. (220) hanno studiato 156.735 donne e 40.536 uomini, che hanno riportato episodi di calcoli renali durante un follow-up medio di 11,3-11,7 anni. Gli autori hanno significativamente correlato l'assunzione totale di vitamina C con un maggiore rischio di calcoli renali negli uomini, ma non nelle donne. Tuttavia, è importante sottolineare che questo studio aveva dei limiti da considerare. La presenza di fattori di confusione (ad esempio, comorbilità, disidratazione, assunzione di alimenti che formano ossalati) non è stata presa in considerazione durante il follow-up, e gli autori hanno valutato l'assunzione di vitamina C solo attraverso un questionario (senza misurare i livelli ematici) e con intervalli di tempo molto lunghi (ogni 4 anni).
Somministrazione endovenosa di vitamina C: Un ruolo potenziale nel trattamento di COVID-19?
Mentre un apporto dietetico supplementare di vitamina C per contrastare la polmonite non sembra promettente, sono emersi diversi dati interessanti dall'uso della vitamina C attraverso la IA, fornendo un'ipotesi incoraggiante, ma messa in discussione, sul suo potenziale uso farmacologico per il trattamento della polmonite causata dall'infezione da SARS-CoV2. Infatti, a differenza dell'integrazione orale, in cui la massima concentrazione plasmatica di picco che è stata raggiunta con una dose elevata (3 g ogni 4 h) era di 220 μmol/L (221), l'IA della vitamina C, bypassando le limitazioni indotte dai trasportatori intestinali (SVCT1), può portare ad un livello plasmatico più elevato (ad esempio, fino a 3.000 μmol/L al giorno 4 con 200 mg/kg/giorno, somministrato in 50 mg/kg/dose ogni 6 h).
Sebbene il potenziale meccanismo terapeutico antisepsi esercitato dalla vitamina C non sia ancora stato compreso (103), oltre agli effetti descritti nei paragrafi precedenti, l'uso della vitamina C in un'emergenza infettiva può essere giustificato per alcuni motivi: 1) significative evidenze cliniche di polmonite, malattie critiche e altre infezioni acute suggeriscono che i livelli plasmatici di vitamina C possono scendere rapidamente (ad esempio, <30 μmol/L) durante la risposta infiammatoria (2, 93, 94, 222-228) probabilmente a causa di un aumento del consumo di vitamina C da parte dei leucociti. Considerando che le concentrazioni di ascorbato intracellulare nelle cellule mononucleari e nei granulociti sono rispettivamente 80 e 25 volte superiori a quelle del plasma, un aumento della sostituzione e del ricambio di queste cellule durante queste condizioni mediche può contribuire ad una diminuzione della vitamina C nel sangue (229); 2) una regolazione negativa dei trasportatori SVCT2 indotta da citochine infiammatorie, in particolare IL-1β e TNFα (230); 3) il sistema di difesa antiossidante dell'epitelio polmonare coinvolge enzimi e vitamina C (231) e secondo Banerjee e Kaul, una dose elevata e sostenuta di vitamina C disponibile nella secrezione respiratoria potrebbe mostrare un'efficace attività antivirale (232). Quest'ultimo punto, tuttavia, è ancora un'ipotesi al momento, poiché il livello di vitamina C nel liquido broncoalveolare è normalmente troppo basso per ottenere un'attività antivirale e inoltre si sa molto poco sul potenziale aumento della concentrazione di vitamina C nel tessuto bronchiale e nella secrezione fluida a seguito di un'alta dose di IA (36).
Pertanto, considerando gli aspetti sopra menzionati, l'infusione di vitamina C è stata recentemente suggerita per il trattamento di COVID-19 in pazienti ospedalizzati in terapia intensiva (13-18). Di seguito, riassumiamo le prove più sostanziali ottenute in studi di malattie critiche basati sulla IA della vitamina C per quanto riguarda gli esiti più rilevanti (infiammazione, tempo di ventilazione e mortalità) che possono riguardare l'ARDS indotta da SARS-CoV2.
Effetti dell'IA della vitamina C sui marcatori di infiammazione
Nei pazienti di COVID-19 la risposta infiammatoria è molto drammatica ed è stata definita come una "tempesta di citochine", associata ad un aumento della concentrazione plasmatica di IL-1β, IL-2, IL-6, IL-10, IFNγ, e TNF-α (233, 234), in grado di indurre una lesione polmonare acuta (ALI) che si traduce in ARDS e richiede interventi urgenti in terapia intensiva (162). La fisiopatologia dell'ARDS comporta un'alterazione della permeabilità polmonare, una rapida infiltrazione dei leucociti polmonari con un forte aumento dello stress ossidativo dei tessuti, che porta all'insufficienza respiratoria e alla morte, che nella maggior parte dei casi è dovuta ad un massiccio danno alveolare (24, 235). Un promettente background sull'uso della vitamina C in un modello sperimentale di ALI è stato trovato (236-241), con prove positive sul riequilibrio della produzione di citochine e specifici meccanismi fisiopatologici che coinvolgono i neutrofili (cioè, trappole extracellulari neutrofili) (4) che possono contribuire al danno d'organo e alla mortalità in COVID-19 (233) (Figura 1). Due studi di Fowler et al. sono attualmente disponibili su IA di vitamina C in pazienti ospedalizzati in terapia intensiva e risposta infiammatoria, con risultati contrastanti (227, 242). Nel primo studio preliminare (227), la vitamina C ha mostrato una riduzione significativa dei biomarcatori proinfiammatori (CRP e procalcitonina) nel corso delle prime 96 ore, senza effetti avversi registrati durante l'infusione, ma il numero di pazienti affetti da ARDS trattati con la vitamina C era troppo piccolo (50 mg/kg/24 h, n = 8; 200 mg/kg/24 h, n = 8) per consentire conclusioni sicure. Nel secondo studio più ampio (242), 167 pazienti con sepsi e ARDS sono stati randomizzati per ricevere la vitamina C (50 mg/kg ogni 6 h per 96 h) o placebo; non sono stati rilevati cambiamenti nella CRP e nella trombomodulina, anche se lo studio è stato criticato per la scelta dei marcatori infiammatori valutati (243).
FIGURA 1
www.frontiersin.org
Figura 1 Meccanismo schematico in cui un IA di vitamina C potrebbe modulare funzioni specifiche dei neutrofili (ROS e TNFα, IL-1β mediato), inibendo le vie coinvolte nella formazione della trappola extracellulare dei neutrofili (NETosi) e riducendo la produzione incontrollabile di citochine infiammatorie nello spazio alveolare. Potenziali effetti sulla riduzione della produzione di citochine sono stati ipotizzati anche nei linfociti e nei macrofagi. ROS, specie reattive dell'ossigeno; NFkB, fattore di trascrizione nucleare kappa B; ┴, stimolo di inibizione; freccia tratteggiata, effetto o produzione ridotta.
Effetti della IA della vitamina C sul tempo di ventilazione in terapia intensiva
Lo studio sopra citato (242) ha anche riportato un tempo di durata inferiore del supporto di ventilazione meccanica nel gruppo integrato, con un numero maggiore di giorni senza ventilatore nel gruppo della vitamina C rispetto al gruppo del placebo (valori medi: 10,6 vs. 13,1 giorni, rispettivamente). I giorni senza ventilatore sono stati definiti come il numero di giorni estubati, considerando il tempo tra il ricovero in terapia intensiva e il giorno 28. Un altro precedente studio randomizzato controllato (RCT), che includeva pazienti ustionati con gravi disfunzioni respiratorie che ricevevano una dose molto elevata di vitamina C (66 mg/kg/h per 24 ore), ha mostrato una significativa diminuzione del tempo di ventilazione (valori medi: 12,1 vs. 21,3 giorni, rispettivamente) in coloro che hanno ricevuto l'infusione di vitamina C rispetto al gruppo di controllo (85). Il beneficio polmonare riportato da questi autori è probabilmente dovuto all'azione antiossidante, antinfiammatoria e microvascolare della vitamina C (244).
Diverse posizioni sull'argomento derivano da una valutazione sistematica della letteratura, sofferente a causa dei limiti grossolani dei dati primari disponibili. Ad esempio, la meta-analisi di Langlois et al. (245), non è riuscita a trovare alcun miglioramento sui tempi di ventilazione. Questo lavoro, tuttavia, comprendeva studi con la vitamina C somministrata attraverso diverse vie (enterale o parenterale), la maggior parte delle quali (9 su un totale di 11 studi) utilizzava miscele antiossidanti invece della sola vitamina C; Zhang e Jativa (244) hanno analizzato l'efficacia dell'IA della vitamina C sugli effetti di risparmio di vasopressori e la minore necessità di ventilazione meccanica nelle malattie critiche, sottolineando diversi punti deboli degli studi disponibili considerati (quattro RCT e una revisione retrospettiva), come la scarsità della dimensione del campione, l'eterogeneità dei soggetti arruolati, l'impostazione del ricovero, i dosaggi e il follow-up; recentemente, la meta-analisi di Hemilä e Chalker (246), che comprende otto studi e 685 pazienti, con risultati promettenti sui tempi di ventilazione, ha evidenziato che la grande variazione degli effetti riportati della vitamina C può essere legata alla gravità non omogenea della malattia che influisce soprattutto sui tempi di ventilazione richiesti. Da questo punto di vista, la vitamina C ha ridotto il tempo di ventilazione in media del 25% quando l'analisi è stata limitata ai pazienti che necessitano di un supporto meccanico per più di 10 ore.
Effetti della IA della vitamina C sulla mortalità
Tra i risultati critici considerati, il potenziale effetto della vitamina C sui tassi di mortalità sembra essere il più controverso, con studi RCT che sottolineano risultati promettenti che non sono supportati da recenti meta-analisi. Una significativa riduzione della mortalità a 28 giorni durante il ricovero in terapia intensiva è stata osservata in un piccolo gruppo di pazienti con sepsi trattati con IA di vitamina C (25 mg/kg ogni 6 h, per 72 h) rispetto al gruppo di controllo (14,28% Vs. 64,28%, rispettivamente) (247). Più recentemente, i risultati dello studio CITRIS-ALI (242) hanno mostrato una ridotta mortalità al giorno 28 nel gruppo della vitamina C (29,8%) rispetto al gruppo del placebo (46,3%). Al contrario, secondo la meta-analisi di Zhang e Jativa, sebbene la vitamina C IA sembri essere legata ad effetti vasopressori positivi, riducendo temporaneamente la necessità di ventilazione meccanica, non è emerso alcun effetto positivo a favore della mortalità complessiva (244), portando gli autori a concludere che sembra improbabile che la vitamina C, considerata come un singolo agente, possa essere così drammaticamente determinante sulla fisiopatologia di una malattia critica da influenzare l'incidenza della mortalità (244). Conclusioni simili sono state tratte da Wei et al. (248), che, includendo nella loro meta-analisi studi retrospettivi pubblicati di recente, suggeriscono la mancanza di benefici sulla mortalità a 28 giorni, sia in terapia intensiva che nei pazienti con sepsi in ospedale.
È importante considerare che l'effetto dell'infusione di vitamina C sembra esercitare risultati diversi sulla mortalità in relazione al tipo di pazienti critici coinvolti, soprattutto quando la somministrazione è in associazione con altri farmaci. Da questo punto di vista, due studi retrospettivi hanno dimostrato che la vitamina C (1,5 g ogni 6 h), in combinazione con idrocortisone (50 mg ogni 6 h) e tiamina (200 mg ogni 12 h) può ridurre drasticamente la mortalità del 56% nei pazienti in terapia intensiva con polmonite grave (249) e del 79% nei pazienti con sepsi grave (250), rispetto ai pazienti che non hanno ricevuto vitamina C e tiamina. A differenza di questi dati, un RCT recentemente pubblicato (VITAMINE) non ha mostrato alcun beneficio dalla combinazione di IA di vitamina C, idrocortisone e tiamina rispetto al solo idrocortisone tra i pazienti con shock settico (251). Tuttavia, come sottolineato da Carr (252), poiché lo studio VITAMINS non includeva un sottogruppo di vitamina C in monoterapia, questo studio non fornisce alcuna informazione sul fatto che l'IA della vitamina C offra un qualche beneficio ai pazienti settici in assenza di somministrazione di corticosteroidi, e sono necessari ulteriori studi in questa direzione.
Un'altra questione critica che dovrebbe essere evidenziata è la tempistica della somministrazione del trattamento. Su questo argomento, risultati importanti provengono da uno studio di coorte retrospettivo su 208 pazienti in shock settico (253), che ha suggerito che il rapporto di mortalità in terapia intensiva [basato sull'APACHE (Acute Physiology and Chronic Health Evaluation)-predicted ICU mortality] dei pazienti che hanno ricevuto la vitamina C con tiamina e idrocortisone, è aumentato linearmente con il ritardo nel trattamento dalla presentazione iniziale della sepsi. Infatti, la mortalità in terapia intensiva regolata con APACHE è stata significativamente ridotta solo nei pazienti che hanno ricevuto vitamina C, tiamina e steroidi entro 6 ore dalla presentazione della sepsi (253).
Conclusione
A parte alcuni individui e condizioni specifiche (Tabella 1), le prove descritte non sono sufficienti a sostenere l'efficacia di un'integrazione regolare con vitamina C per la prevenzione o il trattamento del comune raffreddore o della polmonite nella popolazione generale. Dati interessanti sul possibile uso della vitamina C per prevenire le infezioni riguardano condizioni particolari (ad esempio, soldati e atleti) e soggetti con disturbi metabolici, CVD o fragilità, in cui il potenziale controllo dell'infiammazione da un'integrazione di vitamina C potrebbe rappresentare un aiuto efficace per ridurre il rischio di infezione, anche per COVID-19. Tuttavia, quest'ultima affermazione deve essere adeguatamente supportata da futuri RCT. Anche se l'IA della vitamina C potrebbe essere una terapia adiuvante per ripristinare rapidamente i livelli plasmatici di vitamina C durante la sepsi grave e l'ARDS nei pazienti ospedalizzati in terapia intensiva (254), i suoi effetti sulla risposta all'infiammazione, sul tempo di ventilazione e sui tassi di mortalità rimangono ancora incerti e i risultati di ulteriori RCT, soprattutto nei pazienti con COVID-19, sono urgentemente necessari.
TABELLA 1
www.frontiersin.org
Tabella 1 Sintesi dei risultati della ricerca sull'uso della vitamina C nell'uomo.
Sebbene sia stato registrato un aumento significativo delle vendite di vitamina C subito dopo la dichiarazione dello stato di emergenza della pandemia globale, al momento non vi sono prove che l'integrazione di vitamina C possa proteggere le persone dall'infezione da SARS-CoV2 (255). Allo stato attuale delle conoscenze, gli operatori sanitari hanno la responsabilità di garantire ai pazienti la corretta informazione sulla mancanza di dati a sostegno dell'efficacia di questo integratore per la prevenzione e/o il trattamento di COVID-19 (167, 168).
Contributi dell'autore
Tutti gli autori hanno contribuito all'articolo e hanno approvato la versione presentata. GC e MN hanno concepito l'idea originale del manoscritto e hanno contribuito in egual misura a questo lavoro come autori principali. GD'A ha rivisto il manoscritto prima della presentazione.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che possano essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori ringraziano Simona Aldrovandi per aver generato le illustrazioni delle tavole e Emily Riley per la revisione inglese del manoscritto.
Riferimenti
1. Carr AC, Maggini S, Vitamin C. and immune function. Nutrients (2017) 9:1211. doi: 10.3390/nu9111211
CrossRef Full Text | Google Scholar
2. Carr AC, Rosengrave PC, Bayer S, Chambers S, Mehrtens J, Shaw GM. Hypovitaminosis C and vitamin C deficiency in critically ill patients despite recommended enteral and parenteral intakes. Crit Care (2017) 21:200. doi: 10.1186/s13054-017-1891-y
3. Van Gorkom GNY, Klein Wolterink RGJ, Van Elssen CHMJ, Wieten L, Germeraad WTV, Bos GMJ. Influence of Vitamin C on lymphocytes: An overview. Antioxidants (2018) 7:41. doi: 10.3390/ANTIOX7030041
4. Bozonet SM, Carr AC. The role of physiological vitamin c concentrations on key functions of neutrophils isolated from healthy individuals. Nutrients (2019) 11:1363. doi: 10.3390/nu11061363
6. Bozonet SM, Carr AC, Pullar JM, Vissers MCM. Enhanced human neutrophil vitamin C status, chemotaxis and oxidant generation following dietary supplementation with vitamin C-rich SunGold kiwifruit. Nutrients (2015) 7:2574–88. doi: 10.3390/nu7042574
7. Allan GM, Arroll B. Prevention and treatment of the common cold: Making sense of the evidence. CMAJ (2014) 186:190–99. doi: 10.1503/cmaj.121442
8. Douglas RM, Hemilä H. Vitamin C for preventing and treating the common cold. PloS Med (2005), CD000980. doi: 10.1371/journal.pmed.0020168
9. Douglas RM, Hemilä H, Chalker E, Treacy B. Vitamin C for preventing and treating the common cold. Cochrane Database Syst Rev (2007) CD000980. doi: 10.1002/14651858.CD000980.pub3
10. Heimer KA, Hart AM, Martin LG, Rubio-Wallace S. Examining the evidence for the use of vitamin C in the prophylaxis and treatment of the common cold. J Am Acad Nurse Pract (2009) 21:295–300. doi: 10.1111/j.1745-7599.2009.00409.x
11. Hemilä H. Vitamin C supplementation and the common cold - Was Linus Pauling right or wrong? Int J Vitam Nutr Res (1997) 67:329–35.
12. Hemilä H, Chalker E. Vitamin C for preventing and treating the common cold. Cochrane Database Syst Rev (2013) CD000980. doi: 10.1002/14651858.CD000980.pub4
13. Boretti A, Banik BK. Intravenous vitamin C for reduction of cytokines storm in acute respiratory distress syndrome. PharmaNutrition (2020) 12:100190. doi: 10.1016/j.phanu.2020.100190
14. Cheng RZ. Can early and high intravenous dose of vitamin C prevent and treat coronavirus disease 2019 (COVID-19)? Med Drug Discovery (2020) 5:100028. doi: 10.1016/j.medidd.2020.100028
15. Erol A. High-dose intravenous vitamin C treatment for COVID-19. OSF Prepr (2020). doi: 10.31219/osf.io/p7ex8
16. Hernández A, Papadakos PJ, Torres A, González DA, Vives M, Ferrando C, et al. Two known therapies could be useful as adjuvant therapy in critical patients infected by COVID-19. Rev Esp Anestesiol Reanim (2020) 67:245–52. doi: 10.1016/j.redar.2020.03.004
17. Matthay MA, Aldrich JM, Gotts JE. Treatment for severe acute respiratory distress syndrome from COVID-19. Lancet Respir Med (2020) 8:433–34. doi: 10.1016/S2213-2600(20)30127-2
18. Zhang L, Liu Y. Potential interventions for novel coronavirus in China: A systematic review. J Med Virol (2020) 92:479–90. doi: 10.1002/jmv.25707
19. Worldometer. COVID-19 Coronavirus Pandemic (2020). Available at: https://www.worldometers.info/coronavirus/.
20. Yu F, Du L, Ojcius DM, Pan C, Jiang S. Measures for diagnosing and treating infections by a novel coronavirus responsible for a pneumonia outbreak originating in Wuhan, China. Microbes Infect (2020) 22:74–9. doi: 10.1016/j.micinf.2020.01.003
21. Alhazzani W, Hylander Møller M, Arabi YM, Loeb M, Ng Gong M, Fan E, et al. Surviving Sepsis Campaign: Guidelines on the Management of Critically Ill Adults with Coronavirus Disease 2019 (COVID-19). Crit Care Med J (2020) 48:e440–69. doi: 10.1097/CCM.0000000000004363
22. Singer M, Deutschman CS, Seymour C, Shankar-Hari M, Annane D, Bauer M, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3). JAMA (2016) 315:801–10. doi: 10.1001/jama.2016.0287
23. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet (2020) 395:497–506. doi: 10.1016/S0140-6736(20)30183-5
24. The ARDS Definition Task Force*. Acute Respiratory Distress Syndrome. The Berlin Definition of ARDS. JAMA (2012) 307:2526–33. doi: 10.1001/jama.2012.5669
25. Sun P, Qie S, Liu Z, Ren J, Li K, Xi J. Clinical characteristics of 50 466 hospitalized patients with 2019-nCoV infection. J Med Virol (2020) 92:612–17. doi: 10.1002/jmv.25735
26. Available at: https://clinicaltrials.gov/.
27. Linster CL, Van Schaftingen E. Vitamin C: Biosynthesis, recycling and degradation in mammals. FEBS J (2007) 274:1–22. doi: 10.1111/j.1742-4658.2006.05607.x
28. Frikke-Schmidt H, Tveden-Nyborg P, Lykkesfeldt J. L-dehydroascorbic acid can substitute l-ascorbic acid as dietary vitamin C source in guinea pigs. Redox Biol (2016) 7:8–13. doi: 10.1016/j.redox.2015.11.003
29. Michels AJ, Hagen TM, Frei B. Human Genetic Variation Influences Vitamin C Homeostasis by Altering Vitamin C Transport and Antioxidant Enzyme Function. Annu Rev Nutr (2013) 33:45–70. doi: 10.1146/annurev-nutr-071812-161246
30. Hasselholt S, Tveden-Nyborg P, Lykkesfeldt J. Distribution of vitamin C is tissue specific with early saturation of the brain and adrenal glands following differential oral dose regimens in guinea pigs. Br J Nutr (2015) 113:1539–49. doi: 10.1017/S0007114515000690
31. Kim H, Bae S, Yu Y, Kim Y, Kim H-R, Hwang Y, et al. The Analysis of Vitamin C Concentration in Organs of Gulo -/- Mice Upon Vitamin C Withdrawal. Immune Netw (2012) 12:18–26. doi: 10.4110/in.2012.12.1.18
32. Harrison FE, Green RJ, Dawes SM, May JM. Vitamin C distribution and retention in the mouse brain. Brain Res (2010) 1348:181–86. doi: 10.1016/j.brainres.2010.05.090
33. Toutain PL, Béchu D, Hidiroglou M. Ascorbic acid disposition kinetics in the plasma and tissues of calves. Am J Physiol - Regul Integr Comp Physiol (1997) 273:R1587–97. doi: 10.1152/ajpregu.1997.273.5.r1585
34. Omaye St, Schaus Ee, Kutnink Ma, Hawkes Wc.. Measurement of Vitamin C in Blood Components by High-Performance Liquid Chromatography: Implication in Assessing Vitamin C Status. Ann N Y Acad Sci (1987) 498:389–401. doi: 10.1111/j.1749-6632.1987.tb23776.x
35. Carr AC, Bozonet SM, Pullar JM, Simcock JW, Vissers MCM. Human skeletal muscle ascorbate is highly responsive to changes in vitamin C intake and plasma concentrations. Am J Clin Nutr (2013) 97:800–7. doi: 10.3945/ajcn.112.053207
36. Lykkesfeldt J, Tveden-Nyborg P. The pharmacokinetics of vitamin C. Nutrients (2019) 11:2412. doi: 10.3390/nu11102412
37. Frei B, Birlouez-Aragon I, Lykkesfeldt J. Authors’ perspective: What is the optimum intake of vitamin C in humans? Crit Rev Food Sci Nutr (2012) 52:815–29. doi: 10.1080/10408398.2011.649149
38. Levine M, Padayatty SJ, Espey MG. Vitamin C: A Concentration-Function Approach Yields Pharmacology and Therapeutic Discoveries. Adv Nutr (2011) 2:78–88. doi: 10.3945/an.110.000109
39. Levine M, Conry-Cantilena C, Wang Y, Welch RW, Washko PW, Dhariwal KR, et al. Vitamin C pharmacokinetics in healthy volunteers: Evidence for a recommended dietary allowance. Proc Natl Acad Sci U S A (1996) 93:3704–9. doi: 10.1073/pnas.93.8.3704
40. Nygaard G. On a Novel, Simplified Model Framework Describing Ascorbic Acid Concentration Dynamics. In: 41st Annual International Conference of the IEEE Engineering in Medicine and Biology Society, EMBS (2019). p. 2880–6. doi: 10.1109/EMBC.2019.8857675
41. Lykkesfeldt J, Poulsen HE. Is vitamin C supplementation beneficial? Lessons learned from randomised controlled trials. Br J Nutr (2010) 103:1251–9. doi: 10.1017/S0007114509993229
42. Bechthold A. New reference values for Vitamin C intake. Ann Nutr Metab (2015) 67:13–20. doi: 10.1159/000434757
43. VITAMINE. Assunzione raccomandata per la popolazione (PRI) e assunzione adeguata (AI). sinu.it. Available at: https://sinu.it/2019/07/09/assunzione-raccomandata-per-la-popolazione-pri-e-assunzione-adeguata-ai/ (Accessed June 11, 2020).
44. Carr AC, Lykkesfeldt J. Discrepancies in global vitamin C recommendations: a review of RDA criteria and underlying health perspectives. Crit Rev Food Sci Nutr (2020) 1–14. doi: 10.1080/10408398.2020.1744513
45. Italian Society of Human Nutrition (SINU). LARN Levels of reference intake for nutrients and energy for the Italian population. (2014). Available at: https://sinu.it/tabelle-larn-2014/.
46. EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific Opinion on Dietary Reference Values for vitamin C. EFSA J (2013) 11:3418. doi: 10.2903/j.efsa.2013.3418
47. German Nutrition Society. New Reference Values for Vitamin C Intake. Ann Nutr Metab (2015) 67:13–20. doi: 10.1159/000434757
48. Institute of Medicine (US) Panel on Dietary Antioxidants and Related Compounds. Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids. Washington (DC): National Academies Press (US) (2000). doi: 10.17226/9810
49. Galan P, Viteri FE, Bertrais S, Czernichow S, Faure H, Arnaud J, et al. Serum concentrations of β-carotene, vitamins C and E, zinc and selenium are influenced by sex, age, diet, smoking status, alcohol consumption and corpulence in a general French adult population. Eur J Clin Nutr (2005) 59:1181–90. doi: 10.1038/sj.ejcn.1602230
50. Canoy D, Wareham N, Welch A, Bingham S, Luben R, Day N, et al. Plasma ascorbic acid concentrations and fat distribution in 19 068 British men and women in the European Prospective Investigation into Cancer and Nutrition Norfolk cohort study. Am J Clin Nutr (2005) 82:1203–09. doi: 10.1093/ajcn/82.6.1203
51. Hampl JS, Taylor CA, Johnston CS. Vitamin C Deficiency and Depletion in the United States: The Third National Health and Nutrition Examination Survey, 1988 to 1994. Am J Public Health (2004) 94:870–5. doi: 10.2105/AJPH.94.5.870
52. Jungert A, Neuhäuser-Berthold M. The lower vitamin C plasma concentrations in elderly men compared with elderly women can partly be attributed to a volumetric dilution effect due to differences in fat-free mass. Br J Nutr (2015) 113:859–64. doi: 10.1017/S0007114515000240
53. National Health and Medical Research Council. Nutrient Reference Values for Australia and New Zealand: Executive Summary. (2006).
54. Faure H, Preziosi P, Roussel AM, Bertrais S, Galan P, Hercberg S, et al. Factors influencing blood concentration of retinol, α-tocopherol, vitamin C, and β-carotene in the French participants of the SU.VI.MAX trial. Eur J Clin Nutr (2006) 60:706–17. doi: 10.1038/sj.ejcn.1602372
55. Birlouez-Aragon I, Delcourt C, Tessier F, Papoz L. Associations of age, smoking habits and diabetes with plasma vitamin C of elderly of the POLA study. Int J Vitam Nutr Res (2001) 71:53–9. doi: 10.1024/0300-9831.71.1.53
56. Ravindran RD, Vashist P, Gupta SK, Young IS, Maraini G, Camparini M, et al. Prevalence and risk factors for vitamin C deficiency in North and South India: A two centre population based study in people aged 60 years and over. PloS One (2011) 6:e28588. doi: 10.1371/journal.pone.0028588
57. Martin A. The “apports nutritionnels conseillés (ANC)” for the French population. Reprod Nutr Dev (2001) 41:119–28. doi: 10.1051/rnd:2001100
58. Juhl B, Lauszus FF, Lykkesfeldt J. Is diabetes associated with lower vitamin C status in pregnant women? A prospective study. Int J Vitam Nutr Res (2016) 86:184–89. doi: 10.1024/0300-9831/a000407
59. Lykkesfeldt J, Priemé H, Loft S, Poulsen HE. Effect of smoking cessation on plasma ascorbic acid concentration. Br Med J (1996) 313:91. doi: 10.1136/bmj.313.7049.91
60. Carr AC, Rowe S. Factors affecting vitamin c status and prevalence of deficiency: A global health perspective. Nutrients (2020) 12:1963. doi: 10.3390/nu12071963
61. Suarez EC, Schramm-Sapyta NL. Race differences in the relation of vitamins A, C, E, and β-carotene to metabolic and inflammatory biomarkers. Nutr Res (2014) 34:1–10. doi: 10.1016/j.nutres.2013.10.001
62. Levine M, Wang Y, Padayatty SJ, Morrow J. A new recommended dietary allowance of vitamin C for healthy young women. Proc Natl Acad Sci U S A (2001) 98:9842–6. doi: 10.1073/pnas.171318198
63. Camarena V, Wang G. The epigenetic role of vitamin C in health and disease. Cell Mol Life Sci (2016) 73:1645–58. doi: 10.1007/s00018-016-2145-x
64. Mangge H. Antioxidants, inflammation and cardiovascular disease. World J Cardiol (2014) 6:462–77. doi: 10.4330/wjc.v6.i6.462
65. Ginter E, Simko V, Panakova V. Antioxidants in health and disease. Bratislava Med J (2014) 115:603–6. doi: 10.4149/BLL_2014_116
66. Hong JM, Kim JH, Kang JS, Lee WJ, Hwang Y. Vitamin C is taken up by human T cells via sodium-dependent vitamin C transporter 2 (SVCT2) and exerts inhibitory effects on the activation of these cells in vitro. Anat Cell Biol (2016) 49:88–98. doi: 10.5115/acb.2016.49.2.88
67. Bergsten P, Amitai G, Kehrl J, Dhariwal KR, Klein HG, Levine M. Millimolar concentrations of ascorbic acid in purified human mononuclear leukocytes. Depletion and reaccumulation. J Biol Chem (1990) 265:2584–87.
68. Evans RM, Currie L, Campbell A. The distribution of ascorbic acid between various cellular components of blood, in normal individuals, and its relation to the plasma concentration. Br J Nutr (1982). doi: 10.1079/bjn19820059
69. Winterbourn CC, Vissers MCM. Changes in ascorbate levels on stimulation of human neutrophils. BBA - Mol Cell Res (1983) 763:175–9. doi: 10.1016/0167-4889(83)90041-1
70. Oberritter H, Glatthaar B, Moser U, Schmidt KH. Effect of functional stimulation on ascorbate content in phagocytes under physiological and pathological conditions. Int Arch Allergy Appl Immunol (1986) 81:46–50. doi: 10.1159/000234106
71. Vissers MCM, Wilkie RP. Ascorbate deficiency results in impaired neutrophil apoptosis and clearance and is associated with up-regulation of hypoxia-inducible factor 1α. J Leukoc Biol (2007) 8:1236–44. doi: 10.1189/jlb.0806541
72. Goldschmidt MC. Reduced bactericidal activity in neutrophils from scorbutic animals and the effect of ascorbic acid on these target bacteria in vivo and in vitro. Am J Clin Nutr (1991) 54:1214S–20S. doi: 10.1093/ajcn/54.6.1214s
73. Goldschmidt MC, Masin WJ, Brown LR, Wyde PR. The effect of ascorbic acid deficiency on leukocyte phagocytosis and killing of Actinomyces viscosus. Int J Vitam Nutr Res (1988) 58:326–34.
74. Demaret J, Venet F, Friggeri A, Cazalis M-A, Plassais J, Jallades L, et al. Marked alterations of neutrophil functions during sepsis-induced immunosuppression. J Leukoc Biol (2015) 98:1081–90. doi: 10.1189/jlb.4a0415-168rr
75. Arraes SMA, Freitas MS, Da Silva SV, De Paula Neto HA, Alves-Filho JC, Martins MA, et al. Impaired neutrophil chemotaxis in sepsis associates with GRK expression and inhibition of actin assembly and tyrosine phosphorylation. Blood (2006) 108:2906–13. doi: 10.1182/blood-2006-05-024638
76. Chishti AD, Shenton BK, Kirby JA, Baudouin SV. Neutrophil chemotaxis and receptor expression in clinical septic shock. Intensive Care Med (2004) 30:605–11. doi: 10.1007/s00134-004-2175-y
77. Lenton KJ, Therriault H, Fülöp T, Payette H, Wagner JR. Glutathione and ascorbate are negatively correlated with oxidative DNA damage in human lymphocytes. Carcinogenesis (1999) 20:607–13. doi: 10.1093/carcin/20.4.607
78. Huijskens MJAJ, Walczak M, Koller N, Briedé JJ, Senden-Gijsbers BLMG, Schnijderberg MC, et al. Technical Advance: Ascorbic acid induces development of double-positive T cells from human hematopoietic stem cells in the absence of stromal cells. J Leukoc Biol (2014) 96:1165–75. doi: 10.1189/jlb.1ta0214-121rr
79. Song MH, Nair VS, Oh KI. Vitamin C enhances the expression of IL17 in a Jmjd2-dependent manner. BMB Rep (2017) 50:49–54. doi: 10.5483/BMBRep.2017.50.1.193
80. Vallance S. Relationships between ascorbic acid and serum proteins of the immune system. Br Med J (1977) 2:437–8. doi: 10.1136/bmj.2.6084.437
81. Anderson R, Oosthuizen R, Maritz R, Theron A, Van Rensburg AJ. The effects of increasing weekly doses of ascorbate on certain cellular and humoral immune functions in normal volunteers. Am J Clin Nutr (1980) 33:71–6. doi: 10.1093/ajcn/33.1.71
82. Prinz W, Bloch J, Gilich G, Mitchell G. A systematic study of the effect of vitamin C supplementation on the humoral immune response in ascorbate-dependent mammals. I. The antibody response to sheep red blood cells (a T-dependent antigen) in guinea pigs. Int J Vitam Nutr Res (1980) 50:294–300.
83. Feigen GA, Smith BH, Dix CE, Flynn CJ, Peterson NS, Rosenberg LT, et al. Enhancement of antibody production and protection against systemic anaphylaxis by large doses of vitamin C. Res Commun Chem Pathol Pharmacol (1982) 38:313–33. doi: 10.1016/s0022-5347(17)52586-0
84. Kennes B, Dumont I, Brohee D, Hubert C, Neve P. Effect of vitamin С supplements on cell-mediated immunity in old people. Gerontology (1983) 29:305–10. doi: 10.1159/000213131
85. Tanaka H, Matsuda T, Miyagantani Y, Yukioka T, Matsuda H, Shimazaki S. Reduction of resuscitation fluid volumes in severely burned patients using ascorbic acid administration: A randomized, prospective study. Arch Surg (2000) 135:326–31. doi: 10.1001/archsurg.135.3.326
86. Albers R, Bol M, Bleumink R, Willems AA, Pieters RHH. Effects of supplementation with vitamins A, C, and E, selenium, and zinc on immune function in a murine sensitization model. Nutrition (2003) 19:940–6. doi: 10.1016/S0899-9007(03)00178-3
87. Hesta M, Ottermans C, Krammer-Lukas S, Zentek J, Hellweg P, Buyse J, et al. The effect of vitamin C supplementation in healthy dogs on antioxidative capacity and immune parameters. J Anim Physiol Anim Nutr (Berl) (2009) 93:26–34. doi: 10.1111/j.1439-0396.2007.00774.x
88. Kim JE, Cho HS, Yang HS, Jung DJ, Hong SW, Hung CF, et al. Depletion of ascorbic acid impairs NK cell activity against ovarian cancer in a mouse model. Immunobiology (2012) 217:873–81. doi: 10.1016/j.imbio.2011.12.010
89. Heuser G, Vojdani A. Enhancement of natural killer cell activity and T and B cell function by buffered vitamin C in patients exposed to toxic chemicals: The role of protein kinase - C. Immunopharmacol Immunotoxicol (1997) 19:291–312. doi: 10.3109/08923979709046977
90. Chatterjee IB, Gupta SD, Majumder AK, Nandi BK, Subramanian N. Effect of ascorbic acid on histamine metabolism in scorbutic guinea-pigs. J Physiol (1975) 25:271–9. doi: 10.1113/jphysiol.1975.sp011091
91. Nandi BK, Subramanian N, Majumder AK, Chatterjee IB. Effect of ascorbic acid on detoxification of histamine under stress conditions. Biochem Pharmacol (1974) 23:643–7. doi: 10.1016/0006-2952(74)90629-7
92. Johnston CS, Solomon RE, Corte C. Vitamin c depletion is associated with alterations in blood histamine and plasma free carnitine in adults. J Am Coll Nutr (1996) 15:586–91. doi: 10.1080/07315724.1996.10718634
93. Bonham MJD, Abu-Zidan FM, Simovic MO, Sluis KB, Wilkinson A, Winterbourn CC, et al. Early ascorbic acid depletion is related to the severity of acute pancreatitis. Br J Surg (1999) 86:1296–301. doi: 10.1046/j.1365-2168.1999.01182.x
94. Bakaev VV, Duntau AP. Ascorbic acid in blood serum of patients with pulmonary tuberculosis and pneumonia. Int J Tuberc Lung Dis (2004) 8:263–6.
95. Peng Y, Kwok KHH, Yang PH, Ng SSM, Liu J, Wong OG, et al. Ascorbic acid inhibits ROS production, NF-κB activation and prevents ethanol-induced growth retardation and microencephaly. Neuropharmacology (2005) 48:426–34. doi: 10.1016/j.neuropharm.2004.10.018
96. Maiuolo J, Maretta A, Gliozzi M, Musolino V, Carresi C, Bosco F, et al. Ethanol-induced cardiomyocyte toxicity implicit autophagy and NFkB transcription factor. Pharmacol Res (2018) 133:141–50. doi: 10.1016/j.phrs.2018.04.004
97. Moniruzzaman M, Ghosal I, Das D, Chakraborty SB. Melatonin ameliorates H2O2-induced oxidative stress through modulation of Erk/Akt/ NFkB pathway. Biol Res (2018) 51:17. doi: 10.1186/s40659-018-0168-5
98. Thoma A, Lightfoot AP. Nf-kb and inflammatory cytokine signalling: Role in skeletal muscle atrophy. In: Xiao J, editor. Advances in Experimental Medicine and Biology, vol. 1088. Singapore: Springer (2018). p. 267–79. doi: 10.1007/978-981-13-1435-3_12
99. Bowie AG, O’Neill LAJ. Vitamin C Inhibits NF-κB Activation by TNF Via the Activation of p38 Mitogen-Activated Protein Kinase. J Immunol (2000) 165:7180–8. doi: 10.4049/jimmunol.165.12.7180
100. Cárcamo JM, Pedraza A, Bórquez-Ojeda O, Golde DW. Vitamin C suppresses TNFα-induced NFκB activation by inhibiting IκBα phosphorylation. Biochemistry (2002) 41:12995–3002. doi: 10.1021/bi0263210
101. Cárcamo JM, Pedraza A, Bórquez-Ojeda O, Zhang B, Sanchez R, Golde DW. Vitamin C Is a Kinase Inhibitor: Dehydroascorbic Acid Inhibits IκBα Kinase β. Mol Cell Biol (2004) 24:6645–52. doi: 10.1128/mcb.24.15.6645-6652.2004
102. Li R, Guo C, Li Y, Liang X, Yang L, Huang W. Therapeutic target and molecular mechanism of vitamin C-treated pneumonia: a systematic study of network pharmacology. Food Funct (2020) 11:4765–72. doi: 10.1039/d0fo00421a
103. Li R, Guo C, Li Y, Qin Z, Huang W. Therapeutic targets and signaling mechanisms of vitamin C activity against sepsis: a bioinformatics study. Brief Bioinform (2020) bbaa079. doi: 10.1093/bib/bbaa079
104. Kuiper C, Vissers MCM. Ascorbate as a cofactor for Fe-and 2-oxoglutarate dependent dioxygenases: Physiological activity in tumour growth and progression. Front Oncol (2014) 4:359. doi: 10.3389/fonc.2014.00359
105. Young JI, Züchner S, Wang G. Regulation of the Epigenome by Vitamin C. Annu Rev Nutr (2015) 35:545–64. doi: 10.1146/annurev-nutr-071714-034228
106. Lio CWJ, Rao A. TET enzymes and 5hMC in adaptive and innate immune systems. Front Immunol (2019) 10:210. doi: 10.3389/fimmu.2019.00210
107. Lee Chong T, Ahearn EL, Cimmino L. Reprogramming the Epigenome With Vitamin C. Front Cell Dev Biol (2019) 7:128. doi: 10.3389/fcell.2019.00128
108. Blaschke K, Ebata KT, Karimi MM, Zepeda-Martínez JA, Goyal P, Mahapatra S, et al. Vitamin C induces Tet-dependent DNA demethylation and a blastocyst-like state in ES cells. Nature (2013) 500:222–6. doi: 10.1038/nature12362
109. Minor EA, Court BL, Young JI, Wang G. Ascorbate induces ten-eleven translocation (Tet) methylcytosine dioxygenase-mediated generation of 5-hydroxymethylcytosine. J Biol Chem (2013) 288:13669–74. doi: 10.1074/jbc.C113.464800
110. Ang A, Pullar JM, Currie MJ, Vissers MCM, Vitamin C. and immune cell function in inflammation and cancer. Biochem Soc Trans (2018) 46:1147–59. doi: 10.1042/BST20180169
111. Eccles R. Understanding the symptoms of the common cold and influenza. Lancet Infect Dis (2005) 5:718–25. doi: 10.1016/S1473-3099(05)70270-X
113. Heikkinen T, Järvinen A. The common cold. Lancet (2003) 361:51–9. doi: 10.1016/S0140-6736(03)12162-9
114. Dicpinigaitis PV, Eccles R, Blaiss MS, Wingertzahn MA. Impact of cough and common cold on productivity, absenteeism, and daily life in the United States: ACHOO Survey. Curr Med Res Opin (2015) 31:1519–25. doi: 10.1185/03007995.2015.1062355
115. Pauling L. Evolution and the need for ascorbic acid. Proc Natl Acad Sci U S A (1970) 67:1643–8. doi: 10.1073/pnas.67.4.1643
116. Pauling L. The significance of the evidence about ascorbic acid and the common cold. Proc Natl Acad Sci U S A (1971) 68:2678–81. doi: 10.1073/pnas.68.11.2678
117. Duerbeck NB, Dowling DD, Duerbeck JM. Vitamin C: Promises not kept. Obstet Gynecol Surv (2016) 71:187–93. doi: 10.1097/OGX.0000000000000289
118. Anderson TW, Reid DB, Beaton GH. Vitamin C and the common cold: a double-blind trial. Can Med Assoc J (1972) 107:503–8.
119. Karlowski TR, Chalmers TC, Frenkel LD, Kapikian AZ, Lewis TL, Lynch JM. Ascorbic Acid for the Common Cold: A Prophylactic and Therapeutic Trial. JAMA J Am Med Assoc (1975) 231:1038–42. doi: 10.1001/jama.1975.03240220018013
120. Chalmers TC. Effects of ascorbic acid on the common cold. An evaluation of the evidence. Am J Med (1975) 58:532–6. doi: 10.1016/0002-9343(75)90127-8
121. Dykes MHM, Meier P. Ascorbic Acid and the Common Cold: Evaluation of Its Efficacy and Toxicity. JAMA J Am Med Assoc (1975) 231:1073–9. doi: 10.1001/jama.1975.03240220051025
123. Stone I. Hypoascorbemia, the genetic disease causing the human requirement for exogenous ascorbic acid. Perspect Biol Med (1966) 10:133–4. doi: 10.1353/pbm.1966.0037
124. Elwood PC, Hughes SJ, Leger St AS. A randomized controlled trial of the therapeutic effect of vitamin C in the common cold. Practitioner (1977) 218:133–7.
125. Gómez E, Quidel S, Bravo Soto G, Ortigoza Á.. Does vitamin C prevent the common cold? Medwave (2018) 18:e7235. doi: 10.5867/medwave.2018.04.7236
126. Vorilhon P, Arpajou B, Vaillant Roussel H, Merlin É, Pereira B, Cabaillot A. Efficacy of vitamin C for the prevention and treatment of upper respiratory tract infection. A meta-analysis in children. Eur J Clin Pharmacol (2019) 75:303–11. doi: 10.1007/s00228-018-2601-7
127. Rondanelli M, Miccono A, Lamburghini S, Avanzato I, Riva A, Allegrini P, et al. Self-Care for Common Colds: The Pivotal Role of Vitamin D, Vitamin C, Zinc, and Echinacea in Three Main Immune Interactive Clusters (Physical Barriers, Innate and Adaptive Immunity) Involved during an Episode of Common Colds - Practical Advice on Dosages. Evidence-Based Complement Altern Med (2018) 2018:5813095. doi: 10.1155/2018/5813095
128. Ran L, Zhao W, Wang J, Wang H, Zhao Y, Tseng Y, et al. Extra Dose of Vitamin C Based on a Daily Supplementation Shortens the Common Cold: A Meta-Analysis of 9 Randomized Controlled Trials. BioMed Res Int (2018) 2018:1837634. doi: 10.1155/2018/1837634
129. Hemilä H. Vitamin C Supplementation and Respiratory Infections: a Systematic Review. Mil Med (2004) 169:920–5. doi: 10.7205/milmed.169.11.920
130. Pazzaglia G, Pasternack M. Recent Trends of Pneumonia Morbidity in US Naval Personnel. Mil Med (1983) 148:647–51. doi: 10.1093/milmed/148.8.647
131. Kleemola M, Saikku P, Visakorpi R, Wang SP, Grayston JT, Kleemola M. Epidemics of pneumonia caused by twar, a new chlamydia organism, in military trainees in finland. J Infect Dis (1988) 157:230–6. doi: 10.1093/infdis/157.2.230
132. Scheffer D da L, Latini A. Exercise-induced immune system response: Anti-inflammatory status on peripheral and central organs. Biochim Biophys Acta - Mol Basis Dis (2020) 1866:165823. doi: 10.1016/j.bbadis.2020.165823
133. Simpson RJ, Campbell JP, Gleeson M, Krüger K, Nieman DC, Pyne DB, et al. Can exercise affect immune function to increase susceptibility to infection? Exerc Immunol Rev (2020) 26:8–22.
134. Hull JH, Loosemore M, Schwellnus M. Respiratory health in athletes: facing the COVID-19 challenge. Lancet Respir Med (2020) 8:557–8. doi: 10.1016/S2213-2600(20)30175-2
135. Schwellnus MP, Derman WE, Jordaan E, Page T, Lambert MI, Readhead C, et al. Elite athletes travelling to international destinations <5 time zone differences from their home country have a 2–3-fold increased risk of illness. Br J Sports Med (2012) 46:816–21. doi: 10.1136/bjsports-2012-091395
136. Sassano M, McKee M, Ricciardi W, Boccia S. Transmission of SARS-CoV-2 and Other Infections at Large Sports Gatherings: A Surprising Gap in Our Knowledge. Front Med (2020) 7:277. doi: 10.3389/fmed.2020.00277
137. Kim TK, Lim HR, Byun JS. Vitamin C supplementation reduces the odds of developing a common cold in Republic of Korea Army recruits: randomised controlled trial. BMJ Mil Heal (2020). doi: 10.1136/bmjmilitary-2019-001384. bmjmilitary-2019-001384.
138. Nieman DC. Exercise immunology: Nutritional countermeasures. Can J Appl Physiol (2001) 26 Suppl:S45–55. doi: 10.1139/h2001-041
139. Powers SK, Jackson MJ. Exercise-induced oxidative stress: Cellular mechanisms and impact on muscle force production. Physiol Rev (2008) 88:1243–76. doi: 10.1152/physrev.00031.2007
140. Walsh NP. Nutrition and Athlete Immune Health: New Perspectives on an Old Paradigm. Sport Med (2019) 49:153–68. doi: 10.1007/s40279-019-01160-3
141. Peternelj TT, Coombes JS. Antioxidant supplementation during exercise training: Beneficial or detrimental? Sport Med (2011) 41:1043–69. doi: 10.2165/11594400-000000000-00000
142. Cobley JN, McHardy H, Morton JP, Nikolaidis MG, Close GL. Influence of vitamin C and vitamin E on redox signaling: Implications for exercise adaptations. Free Radic Biol Med (2015) 84:65–76. doi: 10.1016/j.freeradbiomed.2015.03.0180
143. Margaritelis NV, Cobley JN, Paschalis V, Veskoukis AS, Theodorou AA, Kyparos A, et al. Principles for integrating reactive species into in vivo biological processes: Examples from exercise physiology. Cell Signal (2016) 28:256–71. doi: 10.1016/j.cellsig.2015.12.011
144. Merry TL, Ristow M. Do antioxidant supplements interfere with skeletal muscle adaptation to exercise training? J Physiol (2016) 594:5135–47. doi: 10.1113/JP270654
145. Ismaeel A, Holmes M, Papoutsi E, Panton L, Koutakis P. Resistance training, antioxidant status, and antioxidant supplementation. Int J Sport Nutr Exerc Metab (2019) 29:539–47. doi: 10.1123/ijsnem.2018-0339
146. Righi NC, Schuch FB, De Nardi AT, Pippi CM, de Almeida Righi G, Puntel GO, et al. Effects of vitamin C on oxidative stress, inflammation, muscle soreness, and strength following acute exercise: meta-analyses of randomized clinical trials. Eur J Nutr (2020) 59:2827–39. doi: 10.1007/s00394-020-02215-2
147. Rothschild JA, Bishop DJ. Effects of Dietary Supplements on Adaptations to Endurance Training. Sport Med (2020) 50:25–53. doi: 10.1007/s40279-019-01185-8
148. Pastor R, Tur JA. Antioxidant Supplementation and Adaptive Response to Training: A Systematic Review. Curr Pharm Des (2019) 25:1889–912. doi: 10.2174/1381612825666190701164923
149. Mason SA, Trewin AJ, Parker L, Wadley GD. Antioxidant supplements and endurance exercise: Current evidence and mechanistic insights. Redox Biol (2020) 35:101471. doi: 10.1016/j.redox.2020.101471
150. Kerksick CM, Wilborn CD, Roberts MD, Smith-Ryan A, Kleiner SM, Jäger R, et al. ISSN exercise & sports nutrition review update: Research & recommendations. J Int Soc Sports Nutr (2018) 15:38. doi: 10.1186/s12970-018-0242-y
151. Paschalis V, Theodorou AA, Kyparos A, Dipla K, Zafeiridis A, Panayiotou G, et al. Low vitamin C values are linked with decreased physical performance and increased oxidative stress: reversal by vitamin C supplementation. Eur J Nutr (2016) 55:45–53. doi: 10.1007/s00394-014-0821-x
152. Margaritelis NV, Paschalis V, Theodorou AA, Kyparos A, Nikolaidis MG. Antioxidants in personalized nutrition and exercise. Adv Nutr (2018) 9:813–23. doi: 10.1093/ADVANCES/NMY052
153. Mandell LA. Epidemiology and etiology of community-acquired pneumonia. Infect Dis Clin North Am (2004) 18:761–76. doi: 10.1016/j.idc.2004.08.003
154. Ellison RT, Donowitz GR. Acute Pneumonia. Mandell, Douglas, and Bennett"s Principles and Practice of Infectious Diseases. (2014). pp. 823–46.e5. doi: 10.1016/B978-1-4557-4801-3.00069-2.
155. Troeger C, Blacker B, Khalil IA, Rao PC, Cao J, Zimsen SRM, et al. Estimates of the global, regional, and national morbidity, mortality, and aetiologies of lower respiratory infections in 195 countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Infect Dis (2018) 18:1191–210. doi: 10.1016/S1473-3099(18)30310-4
156. Naghavi M, Wang H, Lozano R, Davis A, Liang X, Zhou M, et al. Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: A systematic analysis for the Global Burden of Disease Study 2013. Lancet (2015) 385:117–71. doi: 10.1016/S0140-6736(14)61682-2
157. Erol N, Saglam L, Saglam YS, Erol HS, Altun S, Aktas MS, et al. The Protection Potential of Antioxidant Vitamins Against Acute Respiratory Distress Syndrome: a Rat Trial. Inflammation (2019) 42:1585–94. doi: 10.1007/s10753-019-01020-2
158. Cai Y, Li YF, Tang LP, Tsoi B, Chen M, Chen H, et al. A new mechanism of vitamin C effects on A/FM/1/47(H1N1) virus-induced pneumonia in restraint-stressed mice. BioMed Res Int (2015) 2015:675149. doi: 10.1155/2015/675149
159. Kim WY, Hong SB. Sepsis and acute respiratory distress syndrome: Recent update. Tuberc Respir Dis (Seoul) (2016) 79:53–7. doi: 10.4046/trd.2016.79.2.53
160. Hemilä H, Louhiala P. Vitamin C for preventing and treating pneumonia. Cochrane Database Syst Rev (2013) 8:CD005532. doi: 10.1002/14651858.CD005532.pub3
161. Padhani Z, Moazzam Z, Ashraf A, Bilal H, Salam R, Das J, et al. Vitamin C supplementation for prevention and treatment of pneumonia. Cochrane Database Syst Rev (2020) 4:CD013134. doi: 10.1002/14651858.CD013134.pub2
162. Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet (2020) 395:507–13. doi: 10.1016/S0140-6736(20)30211-7
163. Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med (2020) 382:727–33. doi: 10.1056/NEJMoa2001017
164. Xu Z, Shi L, Wang Y, Zhang J, Huang L, Zhang C, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med (2020) 8:420–2. doi: 10.1016/S2213-2600(20)30076-X
165. Pascarella G, Strumia A, Piliego C, Bruno F, Del Buono R, Costa F, et al. COVID-19 diagnosis and management: a comprehensive review. J Intern Med (2020) 288:192–206. doi: 10.1111/joim.13091
166. Iddir M, Brito A, Dingeo G, Fernandez Del Campo S, Samouda H, La Frano M, et al. Strengthening the Immune System and Reducing Inflammation and Oxidative Stress through Diet and Nutrition: Considerations during the COVID-19 Crisis. Nutrients (2020) 12:1562. doi: 10.3390/nu12061562
167. Adams KK, Baker WL, Sobieraj DM. Myth Busters: Dietary Supplements and COVID-19. Ann Pharmacother (2020) 54:820–6. doi: 10.1177/1060028020928052
168. Bauer SR, Kapoor A, Rath M, Thomas SA. What is the role of supplementation with ascorbic acid, zinc, vitamin D, or N -acetylcysteine for prevention or treatment of COVID-19? Cleve Clin J Med (2020). doi: 10.3949/ccjm.87a.ccc046
169. BourBour F, Mirzaei Dahka S, Gholamalizadeh M, Akbari ME, Shadnoush M, Haghighi M, et al. Nutrients in prevention, treatment, and management of viral infections; special focus on Coronavirus. Arch Physiol Biochem (2020) 1–10. doi: 10.1080/13813455.2020.1791188
170. Toresdahl BG, Asif IM. Coronavirus Disease 2019 (COVID-19): Considerations for the Competitive Athlete. Sport Heal A Multidiscip Approach (2020) 12:221–4. doi: 10.1177/1941738120918876
171. Zabetakis I, Lordan R, Norton C, Tsoupras A. COVID-19: The Inflammation Link and the Role of Nutrition in Potential Mitigation. Nutrients (2020) 12:1466. doi: 10.3390/nu12051466
172. Costa FF, Rosário WR, Ribeiro Farias AC, de Souza RG, Duarte Gondim RS, Barroso WA. Metabolic syndrome and COVID-19: An update on the associated comorbidities and proposed therapies. Diabetes Metab Syndr Clin Res Rev (2020) 14:809–14. doi: 10.1016/j.dsx.2020.06.016
173. World Health Organization. Information note on COVID-19 and NCDs. (2020)Information note on COVID-19 and NCDs . Available at: https://www.who.int/publications/m/item/covid-19-and-ncds (Accessed July 4, 2020).
174. Yang J, Zheng Y, Gou X, Pu K, Chen Z, Guo Q, et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. Int J Infect Dis (2020) 94:91–5. doi: 10.1016/j.ijid.2020.03.017
175. Cai Q, Chen F, Wang T, Luo F, Liu X, Wu Q, et al. Obesity and COVID-19 Severity in a Designated Hospital in Shenzhen, China. Diabetes Care (2020) 43:1392–8. doi: 10.2337/dc20-0576
176. Lighter J, Phillips M, Hochman S, Sterling S, Johnson D, Francois F, et al. Obesity in patients younger than 60 years is a risk factor for Covid-19 hospital admission. Clin Infect Dis (2020) 71:896–7. doi: 10.1093/cid/ciaa415
177. Bhasin A, Nam H, Yeh C, Lee J, Liebovitz D, Achenbach C. Is BMI higher in younger patients with COVID-19? Association between BMI and COVID-19 hospitalization by age. Obesity (2020) 28:1811–4. doi: 10.1002/oby.22947
178. Petrilli CM, Jones SA, Yang J, Rajagopalan H, O’Donnell L, Chernyak Y, et al. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: Prospective cohort study. BMJ (2020) 369:m1966. doi: 10.1136/bmj.m1966
179. Ogden CL, Carroll MD, Kit BK, Flegal KM. Prevalence of childhood and adult obesity in the United States, 2011-2012. JAMA - J Am Med Assoc (2014) (219):1–8. doi: 10.1001/jama.2014.732
180. Mah E, Matos MD, Kawiecki D, Ballard K, Guo Y, Volek JS, et al. Vitamin C Status Is Related to Proinflammatory Responses and Impaired Vascular Endothelial Function in Healthy, College-Aged Lean and Obese Men. J Am Diet Assoc (2011) 111:737–43. doi: 10.1016/j.jada.2011.02.003
181. Block G, Jensen CD, Dalvi TB, Norkus EP, Hudes M, Crawford PB, et al. Vitamin C treatment reduces elevated C-reactive protein. Free Radic Biol Med (2009) 46:70–7. doi: 10.1016/j.freeradbiomed.2008.09.030
182. Rychter AM, Ratajczak AE, Zawada A, Dobrowolska A, Krela-Kaźmierczak I. Non-systematic review of diet and nutritional risk factors of cardiovascular disease in obesity. Nutrients (2020) 12:814. doi: 10.3390/nu12030814
183. Rychter AM, Zawada A, Ratajczak AE, Dobrowolska A, Krela-Kaźmierczak I. Should patients with obesity be more afraid of COVID-19? Obes Rev (2020) 21:e13083. doi: 10.1111/obr.13083
184. Kumar A, Arora A, Sharma P, Anikhindi SA, Bansal N, Singla V, et al. Is diabetes mellitus associated with mortality and severity of COVID-19? A meta-analysis. Diabetes Metab Syndr Clin Res Rev (2020) 14:535–45. doi: 10.1016/j.dsx.2020.04.044
185. International Diabetes Federation. About Diabetes. (2020).. Available at: https://idf.org/aboutdiabetes/type-2-diabetes.html (Accessed July 6, 2020).
186. McArdle MA, Finucane OM, Connaughton RM, McMorrow AM, Roche HM. Mechanisms of obesity-induced inflammation and insulin resistance: Insights into the emerging role of nutritional strategies. Front Endocrinol (Lausanne) (2013) 4:52. doi: 10.3389/fendo.2013.00052
187. Will JC, Byers T. Does Diabetes Mellitus Increase the Requirement for Vitamin C? Nutr Rev (2009) 54:193–202. doi: 10.1111/j.1753-4887.1996.tb03932.x
188. Sargeant LA, Wareham NJ, Bingham S, Day NE, Luben RN, Oakes S, et al. Vitamin C and hyperglycemia in the European Prospective Investigation Into Cancer - Norfolk (EPIC-Norfolk) study. Diabetes Care (2000) 23:726–32. doi: 10.2337/diacare.23.6.726
189. Sinclair AJ, Taylor PB, Lunec J, Girling AJ, Barnett AH. Low Plasma Ascorbate Levels in Patients with Type 2 Diabetes Mellitus Consuming Adequate Dietary Vitamin C. Diabetes Med (1994) 11:893–8. doi: 10.1111/j.1464-5491.1994.tb00375.x
190. Wilson R, Willis J, Gearry R, Skidmore P, Fleming E, Frampton C, et al. Inadequate vitamin C status in prediabetes and type 2 diabetes mellitus: Associations with glycaemic control, obesity, and smoking. Nutrients (2017) 9:997. doi: 10.3390/nu9090997
191. Seghieri G, Martinoli L, Miceli M, Ciuti M, D’Alessandri G, Gironi A, et al. Renal excretion of ascorbic acid in insulin dependent diabetes mellitus. Int J Vitam Nutr Res (1994) 64:119–24.
192. Luc K, Schramm-Luc A, Guzik TJ, Mikolajczyk TP. Oxidative stress and inflammatory markers in prediabetes and diabetes. J Physiol Pharmacol (2019) 70(6). doi: 10.26402/jpp.2019.6.01
193. Mason SA, Della Gatta PA, Snow RJ, Russell AP, Wadley GD. Ascorbic acid supplementation improves skeletal muscle oxidative stress and insulin sensitivity in people with type 2 diabetes: Findings of a randomized controlled study. Free Radic Biol Med (2016) 93:227–38. doi: 10.1016/j.freeradbiomed.2016.01.006
194. Ellulu MS, Rahmat A, Ismail P, Khaza’ai H, Abed Y. Effect of vitamin C on inflammation and metabolic markers in hypertensive and/or diabetic obese adults: a randomized controlled trial. Drug Des Devel Ther (2015) 9:3405–12. doi: 10.2147/DDDT.S83144
195. Ashor AW, Werner AD, Lara J, Willis ND, Mathers JC, Siervo M. Effects of Vitamin C supplementation on glycaemic control: A systematic review and meta-analysis of randomised controlled trials. Eur J Clin Nutr (2017) 71:1371–80. doi: 10.1038/ejcn.2017.24
196. Fang L, Karakiulakis G, Roth M. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? Lancet Respir Med (2020) 8:e21. doi: 10.1016/S2213-2600(20)30116-8
197. Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet (2020) 395:1054–62. doi: 10.1016/S0140-6736(20)30566-3
198. Zheng Z, Peng F, Xu B, Zhao J, Liu H, Peng J, et al. Risk factors of critical & mortal COVID-19 cases: A systematic literature review and meta-analysis. J Infect (2020) 81:e16–25. doi: 10.1016/j.jinf.2020.04.021
199. Gheblawi M, Wang K, Viveiros A, Nguyen Q, Zhong J-C, Turner AJ, et al. Angiotensin-Converting Enzyme 2: SARS-CoV-2 Receptor and Regulator of the Renin-Angiotensin System. Circ Res (2020) 126:1456–74. doi: 10.1161/circresaha.120.317015
200. Chen L, Hao G. The role of angiotensin-converting enzyme 2 in coronaviruses/influenza viruses and cardiovascular disease. Cardiovasc Res (2020) 116:1932–6. doi: 10.1093/cvr/cvaa093
201. Touyz RM, Li H, Delles C. ACE2 the Janus-faced protein – from cardiovascular protection to severe acute respiratory syndrome-coronavirus and COVID-19. Clin Sci (2020) 134:747–50. doi: 10.1042/CS20200363
202. Tan HW, Xu Y, Lau ATY. Angiotensin-converting enzyme 2: The old door for new severe acute respiratory syndrome coronavirus 2 infection. Rev Med Virol (2020) 30:e2122. doi: 10.1002/rmv.2122
203. Khaw KT, Bingham S, Welch A, Luben R, Wareham N, Oakes S, et al. Relation between plasma ascorbic acid and mortality in men and women in EPIC-Norfolk prospective study: A prospective population study. Lancet (2001) 357:657–63. doi: 10.1016/S0140-6736(00)04128-3
204. Pfister R, Sharp SJ, Luben R, Wareham NJ, Khaw KT. Plasma vitamin C predicts incident heart failure in men and women in European Prospective Investigation into Cancer and Nutrition-Norfolk prospective study. Am Heart J (2011) 162:246–53. doi: 10.1016/j.ahj.2011.05.007
205. Ingles DP, Cruz Rodriguez JB, Garcia H. Supplemental Vitamins and Minerals for Cardiovascular Disease Prevention and Treatment. Curr Cardiol Rep (2020) 22:22. doi: 10.1007/s11886-020-1270-1
206. Moser MA, Chun OK, Vitamin C. and heart health: A review based on findings from epidemiologic studies. Int J Mol Sci (2016) 17:1328. doi: 10.3390/ijms17081328
207. Lykkesfeldt J. On the effect of vitamin C intake on human health: How to (mis)interprete the clinical evidence. Redox Biol (2020) 34:101532. doi: 10.1016/j.redox.2020.101532
208. Chow N, Fleming-Dutra K, Gierke R, Hall A, Hughes M, Pilishvili T, et al. Preliminary Estimates of the Prevalence of Selected Underlying Health Conditions Among Patients with Coronavirus Disease 2019 — United States, February 12–March 28, 2020. MMWR Morb Mortal Wkly Rep (2020) 69:382–6. doi: 10.15585/mmwr.mm6913e2
209. Wu C, Chen X, Cai Y, Xia J, Zhou X, Xu S, et al. Risk Factors Associated with Acute Respiratory Distress Syndrome and Death in Patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med (2020) 180:934–43. doi: 10.1001/jamainternmed.2020.0994
210. Pae M, Meydani SN, Wu D. The role of nutrition in enhancing immunity in aging. Aging Dis (2012) 3:91–129.
211. Meyer KC. The role of immunity and inflammation in lung senescence and susceptibility to infection in the elderly. Semin Respir Crit Care Med (2010) 31:561–74. doi: 10.1055/s-0030-1265897
212. Volkert D, Visser M, Corish CA, Geisler C, de Groot L, Cruz-Jentoft AJ, et al. Joint action malnutrition in the elderly (MaNuEL) knowledge hub: summary of project findings. Eur Geriatr Med (2020) 11:169–77. doi: 10.1007/s41999-019-00264-3
213. Power SE, Jeffery IB, Ross RP, Stanton C, O’Toole PW, O’Connor EM, et al. Food and nutrient intake of irish community-dwelling elderly subjects: Who is at nutritional risk? J Nutr Heal Aging (2014) 18:561–72. doi: 10.1007/s12603-014-0449-9
214. Haase H, Rink L. The immune system and the impact of zinc during aging. Immun Ageing (2009) 6:9. doi: 10.1186/1742-4933-6-9
215. Hunt C, Chakravorty NK, Annan G, Habibzadeh N, Schorah CJ. The clinical effects of vitamin C supplementation in elderly hospitalised patients with acute respiratory infections. Int J Vitam Nutr Res (1994) 64:212–9.
216. Fletcher AE, Breeze E, Shetty PS. Antioxidant vitamins and mortality in older persons: Findings from the nutrition add-on study to the Medical Research Council Trial of Assessment and Management of Older People in the Community. Am J Clin Nutr (2003) 78:999–1010. doi: 10.1093/ajcn/78.5.999
217. Yanase F, Fujii T, Naorungroj T, Belletti A, Luethi N, Carr AC, et al. Harm of IV High-Dose Vitamin C Therapy in Adult Patients. Crit Care Med (2020) 48:e620–8. doi: 10.1097/CCM.0000000000004396
218. Traxer O, Huet B, Poindexter J, Pak CYC, Pearle MS. Effect of ascorbic acid consumption on urinary stone risk factors. J Urol (2003) 170:397–401. doi: 10.1097/01.ju.0000076001.21606.53
219. Massey LK, Liebman M, Kynast-Gales SA. Ascorbate Increases Human Oxaluria and Kidney Stone Risk. J Nutr (2005) 135:1673–7. doi: 10.1093/jn/135.7.1673
220. Ferraro PM, Curhan GC, Gambaro G, Taylor EN. Total, dietary, and supplemental Vitamin C intake and risk of incident kidney stones. Am J Kidney Dis (2016) 67:400–7. doi: 10.1053/j.ajkd.2015.09.005
221. Padayatty SJ, Sun H, Wang Y, Riordan HD, Hewitt SM, Katz A, et al. Vitamin C Pharmacokinetics: Implications for Oral and Intravenous Use. Ann Intern Med (2004) 140:533–7. doi: 10.7326/0003-4819-140-7-200404060-00010
222. Galley HF, Davies MJ, Webster NR. Ascorbyl radical formation in patients with sepsis: Effect of ascorbate loading. Free Radic Biol Med (1996) 20:139–43. doi: 10.1016/0891-5849(95)02022-5
223. Schorah CJ, Downing C, Piripitsi A, Gallivan L, Al-Hazaa AH, Sanderson MJ, et al. Total vitamin C, ascorbic acid, and dehydroascorbic acid concentrations in plasma of critically ill patients. Am J Clin Nutr (1996) 63:760–5. doi: 10.1093/ajcn/63.5.760
224. Metnitz PGH, Bartens C, Fischer M, Fridrich P, Steltzer H, Druml W. Antioxidant status in patients with acute respiratory distress syndrome. Intensive Care Med (1999) 25:180–5. doi: 10.1007/s001340050813
225. Kieffer P, Thannberger P, Wilhelm JM, Kieffer C, Schneider F. Multiple organ dysfunction dramatically improving with the infusion of vitamin C: More support for the persistence of scurvy in our “welfare” society. Intensive Care Med (2001) 27:448. doi: 10.1007/s001340000830
226. Long CL, Maull KI, Krishnan RS, Laws HL, Geiger JW, Borghesi L, et al. Ascorbic acid dynamics in the seriously ill and injured. J Surg Res (2003) 109:144–8. doi: 10.1016/S0022-4804(02)00083-5
227. Fowler AA, Syed AA, Knowlson S, Sculthorpe R, Farthing D, DeWilde C, et al. Phase I safety trial of intravenous ascorbic acid in patients with severe sepsis. J Transl Med (2014) 12:32. doi: 10.1186/1479-5876-12-32
228. Carr AC, Spencer E, Dixon L, Chambers ST. Patients with community acquired pneumonia exhibit depleted vitamin c status and elevated oxidative stress. Nutrients (2020) 12:1318. doi: 10.3390/nu12051318
229. Oudemans-van Straaten HM, Spoelstra-de Man AME, de Waard MC. Vitamin C revisited. Crit Care (2014) 18:460. doi: 10.1186/s13054-014-0460-x
230. Seno T, Inoue N, Matsui K, Ejiri J, Hirata KI, Kawashima S, et al. Functional expression of sodium-dependent vitamin C transporter 2 in human endothelial cells. J Vasc Res (2004) 41:345–51. doi: 10.1159/000080525
231. Schmidt R, Luboeinski T, Markart P, Ruppert C, Daum C, Grimminger F, et al. Alveolar antioxidant status in patients with acute respiratory distress syndrome. Eur Respir J (2004) 24:994–9. doi: 10.1183/09031936.04.00120703
232. Banerjee D, Kaul D. Combined inhalational and oral supplementation of ascorbic acid may prevent influenza pandemic emergency: A hypothesis. Nutrition (2010) 26:128–32. doi: 10.1016/j.nut.2009.09.015
233. Barnes BJ, Adrover JM, Baxter-Stoltzfus A, Borczuk A, Cools-Lartigue J, Crawford JM, et al. Targeting potential drivers of COVID-19: Neutrophil extracellular traps. J Exp Med (2020) 217:e20200652. doi: 10.1084/jem.20200652
234. McGonagle D, Sharif K, O’Regan A, Bridgewood C. The Role of Cytokines including Interleukin-6 in COVID-19 induced Pneumonia and Macrophage Activation Syndrome-Like Disease. Autoimmun Rev (2020) 19:102537. doi: 10.1016/j.autrev.2020.102537
235. Pierrakos C, Karanikolas M, Scolletta S, Karamouzos V, Velissaris D. Acute respiratory distress syndrome: pathophysiology and therapeutic options. J Clin Med Res (2012) 4:7–16. doi: 10.4021/jocmr761w
236. Chen Y, Luo G, Yuan J, Wang Y, Yang X, Wang X, et al. Vitamin C Mitigates Oxidative Stress and Tumor Necrosis Factor-Alpha in Severe Community-Acquired Pneumonia and LPS-Induced Macrophages. Mediators Inflammation (2014) 2014:426740. doi: 10.1155/2014/426740
237. Härtel C, Strunk T, Bucsky P, Schultz C. Effects of vitamin C on intracytoplasmic cytokine production in human whole blood monocytes and lymphocytes. Cytokine (2004) 27:101–6. doi: 10.1016/j.cyto.2004.02.004
238. Fisher BJ, Seropian IM, Kraskauskas D, Thakkar JN, Voelkel NF, Fowler AA, et al. Ascorbic acid attenuates lipopolysaccharide-induced acute lung injury. Crit Care Med (2011) 39:1454–60. doi: 10.1097/CCM.0b013e3182120cb8
239. Fisher BJ, Kraskauskas D, Martin EJ, Farkas D, Wegelin JA, Brophy D, et al. Mechanisms of attenuation of abdominal sepsis induced acute lung injury by ascorbic acid. Am J Physiol - Lung Cell Mol Physiol (2012) 303:L20–32. doi: 10.1152/ajplung.00300.2011
240. Molina N, Morandi AC, Bolin AP, Otton R. Comparative effect of fucoxanthin and vitamin C on oxidative and functional parameters of human lymphocytes. Int Immunopharmacol (2014) 22:41–50. doi: 10.1016/j.intimp.2014.06.026
241. Zhang XY, Xu ZP, Wang W, Cao JB, Fu Q, Zhao WX, et al. Vitamin C alleviates LPS-induced cognitive impairment in mice by suppressing neuroinflammation and oxidative stress. Int Immunopharmacol (2018) 65:438–47. doi: 10.1016/j.intimp.2018.10.020
242. Fowler AA, Truwit JD, Hite RD, Morris PE, Dewilde C, Priday A, et al. Effect of Vitamin C Infusion on Organ Failure and Biomarkers of Inflammation and Vascular Injury in Patients with Sepsis and Severe Acute Respiratory Failure: The CITRIS-ALI Randomized Clinical Trial. JAMA (2019) 322:1261–70. doi: 10.1001/jama.2019.11825
243. Marik PE, Payen D. CITRIS-ALI: How statistics were used to obfuscate the true findings. Anaesth Crit Care Pain Med (2019) 38:575–7. doi: 10.1016/j.accpm.2019.10.004
244. Zhang M, Jativa DF. Vitamin C supplementation in the critically ill: A systematic review and meta-analysis. SAGE Open Med (2018) 6:2050312118807615. doi: 10.1177/2050312118807615
245. Langlois PL, Manzanares W, Adhikari NKJ, Lamontagne F, Stoppe C, Hill A, et al. Vitamin C Administration to the Critically Ill: A Systematic Review and Meta-Analysis. JPEN J Parenter Enteral Nutr (2019) 43:335–46. doi: 10.1002/jpen.1471
246. Hemilä H, Chalker E. Vitamin C may reduce the duration of mechanical ventilation in critically ill patients: A meta-regression analysis. J Intensive Care (2020) 8:15. doi: 10.1186/s40560-020-0432-y
247. Zabet M, Mohammadi M, Ramezani M, Khalili H. Effect of high-dose Ascorbic acid on vasopressor′s requirement in septic shock. J Res Pharm Pract (2016) 5:94–100. doi: 10.4103/2279-042x.179569
248. Wei X, Wang Z, Liao X, Guo W, Wen JY, Qin T, et al. Efficacy of vitamin C in patients with sepsis: An updated meta-analysis. Eur J Pharmacol (2020) 868:172889. doi: 10.1016/j.ejphar.2019.172889
249. Kim WY, Jo EJ, Eom JS, Mok J, Kim MH, Kim KU, et al. hydrocortisone, and thiamine therapy for patients with severe pneumonia who were admitted to the intensive care unit: Propensity score-based analysis of a before-after cohort study. J Crit Care (2018) 47:211–8. doi: 10.1016/j.jcrc.2018.07.004
250. Marik PE, Khangoora V, Rivera R, Hooper MH, Catravas J. Hydrocortisone, Vitamin C, and Thiamine for the Treatment of Severe Sepsis and Septic Shock: A Retrospective Before-After Study. Chest (2017) 151:1229–38. doi: 10.1016/j.chest.2016.11.036
251. Fujii T, Luethi N, Young PJ, Frei DR, Eastwood GM, French CJ, et al. Effect of Vitamin C, Hydrocortisone, and Thiamine vs Hydrocortisone Alone on Time Alive and Free of Vasopressor Support among Patients with Septic Shock: The VITAMINS Randomized Clinical Trial. JAMA (2020) 323:423–31. doi: 10.1001/jama.2019.22176
252. Carr AC. Is the VITAMINS RCT indicating potential redundancy between corticosteroids and vitamin C? Crit Care (2020) 24:129. doi: 10.1186/s13054-020-02853-2
253. Frommelt MA, Kory P, Long MT. Letter on Update to the Vitamin C, Thiamine, and Steroids in Sepsis (VICTAS) Protocol. Trials (2020) 21:350. doi: 10.1186/s13063-020-04289-z
254. Carr AC. Vitamin C in Pneumonia and Sepsis. In: Chen Q, Vissers MCM, editors. Vitamin C: New Biochemical and Functional Insights. Boca Raton, FL: CRC Press (2020). p. 115–35. doi: 10.1201/9780429442025-7
255. Romano S, Galante H, Figueira D, Mendes Z, Rodrigues AT. Time-trend analysis of medicine sales and shortages during COVID-19 outbreak: Data from community pharmacies. Res Soc Adm Pharm (2020) 1551-7411(20):30611–2. doi: 10.1016/j.sapharm.2020.05.024
Keywords: vitamin C supplementation, viral infections, COVID-19, pneumonia, immune function, athletes, non-communicable diseases, frail elderly subjects
Citation: Cerullo G, Negro M, Parimbelli M, Pecoraro M, Perna S, Liguori G, Rondanelli M, Cena H and D’Antona G (2020) The Long History of Vitamin C: From Prevention of the Common Cold to Potential Aid in the Treatment of COVID-19. Front. Immunol. 11:574029. doi: 10.3389/fimmu.2020.574029
Received: 18 June 2020; Accepted: 21 September 2020;
Published: 28 October 2020.
Edited by:
Ioannis Zabetakis, University of Limerick, IrelandReviewed by:
Ran Wei, The State University of New Jersey, United StatesAnitra C. Carr, University of Otago, New Zealand
Copyright © 2020 Cerullo, Negro, Parimbelli, Pecoraro, Perna, Liguori, Rondanelli, Cena and D’Antona. This is an open-access article distributed under the terms of the Creative Commons Attribution License (CC BY). The use, distribution or reproduction in other forums is permitted, provided the original author(s) and the copyright owner(s) are credited and that the original publication in this journal is cited, in accordance with accepted academic practice. No use, distribution or reproduction is permitted which does not comply with these terms.
*Correspondence: Massimo Negro, massimo.negro@unipv.it
†These authors have contributed equally to this work
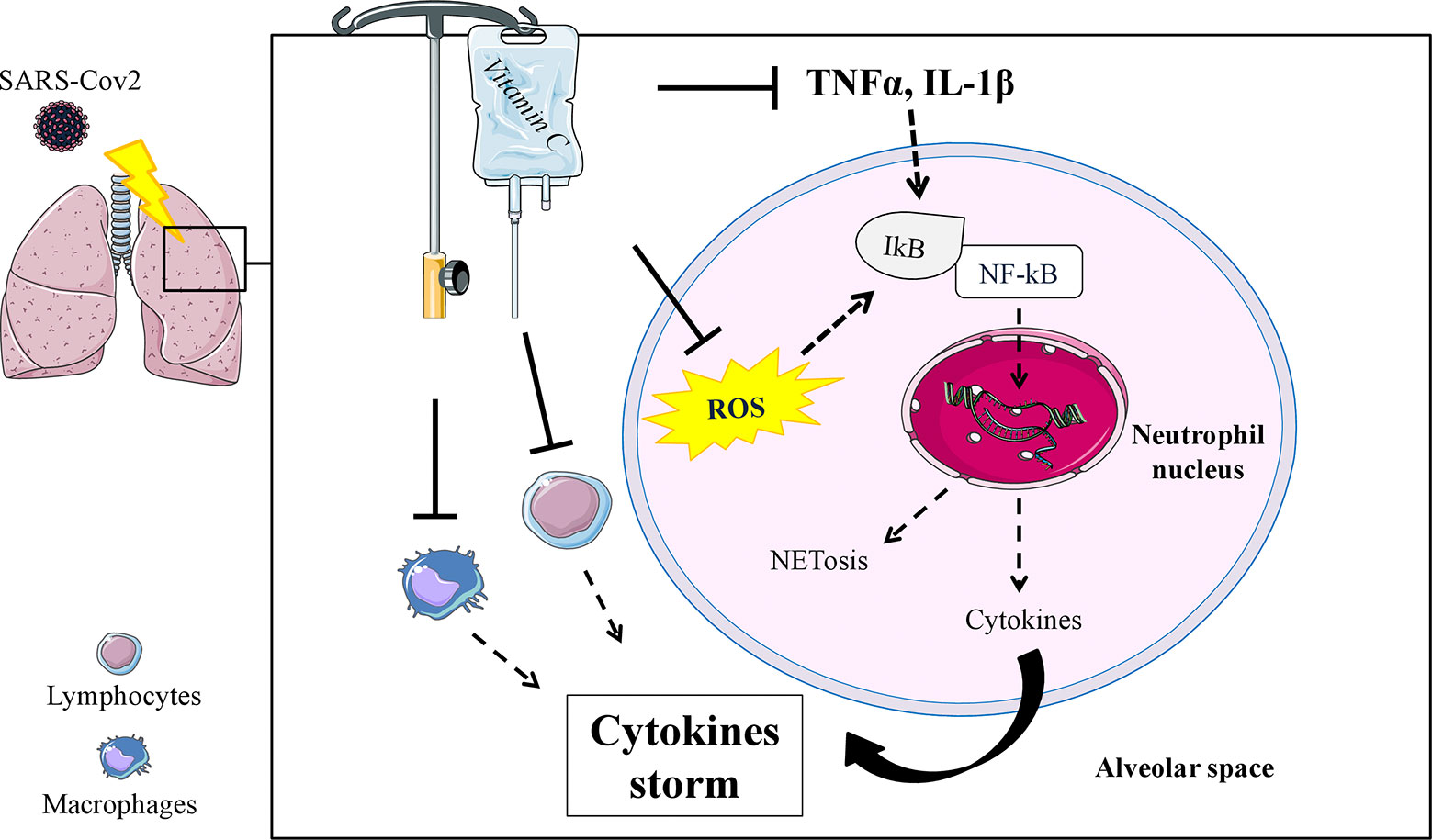


Nessun commento:
Posta un commento